题目内容
【题目】H2S是一种大气污染物。工业尾气中含有H2S,会造成严重的环境污染;未脱除H2S的煤气,运输过程中还会腐蚀管道。
(1)干法氧化铁脱硫是目前除去煤气中H2S的常用方法,其原理如图所示。
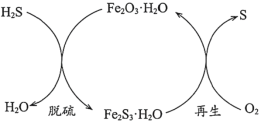
①下列说法正确的是____________(填序号)。
a.单质硫为淡黄色固体
b.脱硫反应为3H2S+Fe2O3·H2O=3H2O+Fe2S3·H2O
c.再生过程中,硫元素被还原
d.脱硫过程中,增大反应物的接触面积可提高脱硫效率
②从安全环保的角度考虑,再生过程需控制反应温度不能过高的原因是_______。
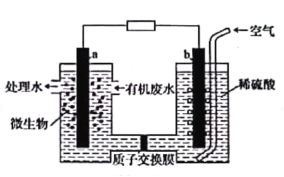
(2)电化学溶解一沉淀法是一种回收利用H2S的新方法,其工艺原理如下图所示。
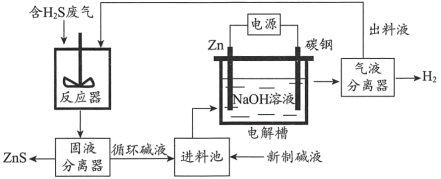
已知: Zn与强酸、强碱都能反应生成H2;Zn(II)在过量的强碱溶液中以[Zn(OH)4]2-形式存在。
①锌棒连接直流电源的____________(填“正极”或“负极”)。
②反应器中反应的离子方程式为____________。
③电解槽中,没接通电源时已经有H2产生,用化学用语解释原因:___________。
(3)常用碘量法测定煤气中H2S的含量,其实验过程如下:
i.将10L煤气通入盛有100mL锌氨络合液的洗气瓶中,将其中的H2S全部转化为ZnS沉淀,过滤;
ii.将带有沉淀的滤纸加入盛有15mL 0.1mol/L碘标准液、200mL水和10mL盐酸的碘量瓶中,盖上瓶塞,摇动碘量瓶至瓶内滤纸摇碎,置于暗处反应10 min后,用少量水冲洗瓶壁和瓶塞。(已知:ZnS+I2=ZnI2+S)
iii.用0.1mol/L Na2S2O3标准液滴定,待溶液呈淡黄色时,加入1mL淀粉指示剂,继续滴定至终点。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①i中,将煤气中的H2S转化为ZnS的目的是____________。
②滴定终点的现象是__________________。
③若消耗Na2S2O3标准液的体积为20mL,则煤气中![]() 的含量为_______________mg/m3。
的含量为_______________mg/m3。
【答案】abd 防止硫粉燃烧产生SO2,污染环境、导致爆炸 正极 [Zn(OH)4]2-+H2S=ZnS↓+2OH-+2H2O Zn+2OH-+2H2O=[Zn(OH)4]2-+H2↑ 富集、提纯煤气中的H2S 溶液蓝色恰好消失,且半分钟内不恢复蓝色 1700
【解析】
(1)干法氧化铁脱硫的过程是将氧化铁和H2S相互接触,二者发生反应生成Fe2S3·H2O从而达到脱硫的目的,化学方程式为3H2S+Fe2O3·H2O=3H2O+Fe2S3·H2O,同时生成的Fe2S3·H2O可以通过再生的方法将S单质分离出来,化学方程式为2Fe2S3·H2O+3O2=2Fe2O3·H2O+6S,这样既可以脱硫又可以将硫进行回收;
(2)电化学溶解-沉淀法是一种回收利用H2S的新方法,实验过程是以Zn为阳极在碱性条件下发生电解,生成[Zn(OH)4]2-,将[Zn(OH)4]2-与H2S气体在反应器中发生反应生成ZnS固体,达到回收利用H2S的方法;
(3)利用碘量法测定煤气中H2S的含量,首先将煤气通入锌氨溶液中将S元素富集起来,将生成的ZnS与碘水混合,二者发生反应,因I2为足量,所以I2剩余,通过碘量法测量未参加反应的I2的含量间接测量煤气中H2S的含量。
(1)①单质硫为淡黄色固体,a正确;根据分析,脱硫反应的化学方程式为3H2S+Fe2O3·H2O=3H2O+Fe2S3·H2O,b正确;再生过程中S元素化合价从-2价变为0价,反应过程中失去电子,发生氧化反应被氧化,c错误;脱硫过程中,增大反应物与气体的接触面积,可以使固体与气体的反应更加完全,提高脱硫效率,d正确;故选abd;
②再生反应不易温度过高,在高温条件下,再生过程生成的硫单质易与氧气发生反应生成SO2污染空气;
(2)①根据分析,若想通过Zn吸收S2-,需将Zn变成Zn2+,通过反应生成ZnS沉淀。此时在电解池中Zn电极一定为阳极,与电源正极相连,电极方程式为Zn-2e-+4OH-=[Zn(OH)4]2-,阴极为水中H+得电子的反应,方程式为2H2O+2e-=H2↑+2OH-;
②电解过程中生成的[Zn(OH)4]2-与H2S发生反应生成ZnS,反应的离子方程式为[Zn(OH)4]2-+H2S=ZnS↓+2OH-+2H2O;
③根据已知条件,Zn可以在强碱中发生反应,生成氢气,故反应的离子方程式为Zn+2OH-+2H2O=[Zn(OH)4]2-+H2↑;
(3)①煤气中H2S含量较低,难以直接测量,故需要将煤气通入到锌氨溶液中,将S元素全部转化为ZnS固体,利用少量的液体将含量低的H2S收集起来,这样起到富集、提纯煤气中的H2S的目的;
②滴定终点时,体系中不再出现I2,溶液颜色发生变化,故滴定终点的现象是:溶液蓝色恰好消失,且半分钟内不恢复蓝色;
③碘量法测定I2含量时,消耗硫代硫酸钠20mL,根据化学方程式,设与硫代硫酸钠反应的I2的物质的量为x mol,则
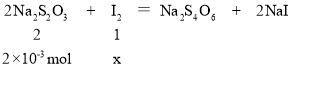
解得x=1×10-3mol,说明与ZnS反应的I2的物质的量为1.5×10-3mol-1×10-3mol=5×10-4mol,根据化学方程式可知参加反应的ZnS的物质的量为5×10-4mol,说明含有S元素5×10-4mol,故H2S为5×10-4mol,即10L煤气中含有5×10-4mol的H2S,煤气中H2S的含量为![]() =1700mg/m3。
=1700mg/m3。

【题目】汽车尾气污染是由汽车排放的废气造成的环境污染。主要污染物为一氧化碳、碳氢化合物、氮氧化合物等,对人类和动、植物危害甚大。解决汽车尾气问题的主要方法是研究高效催化剂促使尾气中的一氧化碳和氮氧化物反应,转化成无污染的氮气和二氧化碳。
回答下列问题:
(1)在Co+的催化作用下,CO(g)还原N2O(g)的反应历程和能量变化如图所示(逸出后物质认为状态下发生变化,在图中略去)。已知总反应的化学方程式为:CO(g)+N2O(g)![]() CO2(g)+N2(g)。
CO2(g)+N2(g)。
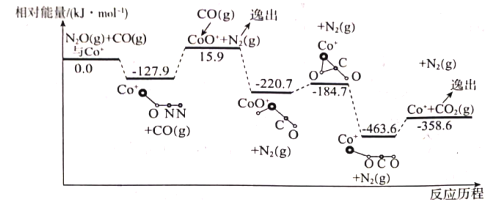
该反应分两步进行:
第一步:Co+(s)+N2O(g)![]() CoO+(s)+N2(g) △H1=+15.9kJmol-1;
CoO+(s)+N2(g) △H1=+15.9kJmol-1;
笫二步:___;△H2=___;
①填写第二步反应的热化学方程式,并根据反应历程图计算△H2的数值。
②该反应的最高能垒(活化能)为___。
(2)500℃条件下,在容积均为2L的三个密闭容器中,按不同方式投入反应物,发生上述反应,测得相关数据如下表:
容器 | 反应物投入的量 | 平衡时 n(N2/mol) | 达到平衡所需时间/min | 平衡时能量变化/kJ |
甲 | 1molCO和1molN2O | n1 | t1 | 放热Q1 |
乙 | 2molCO和2molN2O | n2 | t2 | 放热Q2 |
丙 | 2molCO2和2molN2 | n3 | t3 | 吸热Q3 |
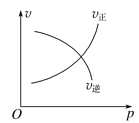
①Q1+![]() ___358.6(填“>”“=”或“<”下同,t1___t2;
___358.6(填“>”“=”或“<”下同,t1___t2;
②500℃条件下,乙和丙两容器,气体混合物中N2O的物质的量分数x(N2O)与反应时间t的关系如下表:
t/s | 0 | 20 | 40 | 60 | 80 | 120 | |
乙 | x(N2O) | 0.5 | 0.32 | 0.20 | 0.12 | 0.088 | 0.07 |
丙 | x(N2O) | 0 | 0.030 | 0.048 | 0.059 | 0.065 | 0.07 |
根据上述实验结果,计算出乙容器中0~20s时间内的化学反应速率v(CO)=___;该反应的平衡常数K数值为:___;(保留3位有效数字)
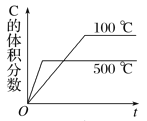
③请推测并在图中画出甲容器中x(N2O)随时间变化的关系图象,标出恰好达到平衡时刻点的位置___。

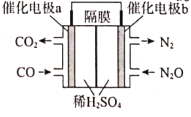
(3)若将CO(g)还原N2O(g)的反应设计成如图的原电池装置,则该电池正极的电极反应式为___。