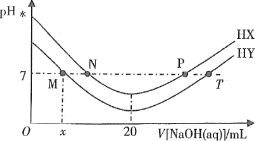
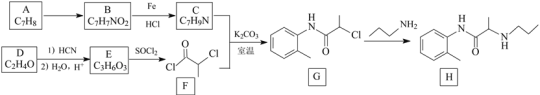
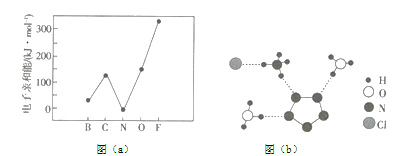
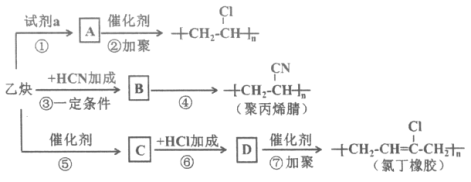
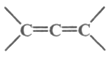题目内容
【题目】表中是元素周期表的一部分,回答下列有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素符号:①_______,⑥_______,⑦_______,_________。
(2)在这些元素形成的单质中,最活泼的金属单质是_____________,最活泼的非金属单质是_________(用化学符号做答)。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是(填化学式,下同)____________,碱性最强的是____________,呈两性的是___________,以上三者之间相互反应的化学方程式:________________________;________________________;________________________
(4)在④与⑤形成的单质中,化学性质较活泼的是____________(填名称),设计两个原理不同的简单实验。
方案一:________________________________________________;
方案二:________________________________________________。
(5)在⑦与⑧形成的单质中,化学性质较活泼的是____________,写出可以证明该结论的一个离子反应方程式________________________。
【答案】N ![]() S
S ![]() K
K ![]()
![]()
![]()
![]()
![]()
![]()
![]() 镁 用
镁 用![]() 条和
条和![]() 片分别和同浓度的盐酸反应,观察其反应速率的快慢 分别向
片分别和同浓度的盐酸反应,观察其反应速率的快慢 分别向![]() 溶液、
溶液、![]() 溶液中加入
溶液中加入![]() 溶液,观察其沉淀及其溶解情况 氯气 Cl2+2H2S=2H++2Cl-+S↓
溶液,观察其沉淀及其溶解情况 氯气 Cl2+2H2S=2H++2Cl-+S↓
【解析】
由元素在周期表中位置可知,①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦S、⑧为Cl、⑨为Ar、⑩为K、为Ca、为Br,结合元素周期律分析解答。
(1)由元素在周期表中位置可知,①、⑥、⑦、分别为N、Si、S、Ca,故答案为:N;Si;S;Ca;
(2)同周期自左而右,金属性减弱、非金属性增强,同主族自上而下,金属性增强、非金属性减弱,故上述元素中最活泼的金属元素是⑩,为K元素;最活泼的非金属元素是②,为F元素,故答案为:K;F2;
(3)非金属性越强,最高价含氧酸的酸性越强,F元素没有最高价含氧酸,故HClO4的酸性最强;金属性越强,最高价氧化物对应水化物的碱性越强,故KOH的碱性最强;Al(OH)3是两性氢氧化物,以上三者之间相互反应的化学方程式为:![]() 、
、![]() 、
、![]() ,故答案为:HClO4;KOH;Al(OH)3;
,故答案为:HClO4;KOH;Al(OH)3;![]() ;
;![]() ;
;![]() ;
;
(4)在④与⑤形成的单质中,化学性质较活泼的是镁,要验证该结论可以通过二者单质分别与水反应的剧烈程度来判断,也可以根据氢氧化镁和氢氧化铝的碱性强弱来判断,因此方案一:用镁条和铝片分别和同浓度的盐酸反应,观察其反应速率的快慢,方案二:分别向AlCl3溶液、氯化镁溶液中加入NaOH溶液,观察其沉淀及其溶解情况,故答案为:镁;用镁条和铝片分别和同浓度的盐酸反应,观察其反应速率的快慢;分别向AlCl3溶液、氯化镁溶液中加入NaOH溶液,观察其沉淀及其溶解情况;
(5)⑧和⑦分别是Cl和S,根据同周期元素非金属性的递变规律可知,非金属性Cl>S,根据判断非金属性强弱的方法,可依据二者气态氢化物的稳定性、单质之间的置换反应等来判断其非金属性强弱,因此可以证明该结论的一个离子反应方程式可以为Cl2+2H2S=2HCl+S↓,故答案为:氯气;Cl2+2H2S=2H++2Cl-+S↓。