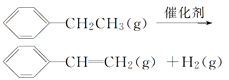题目内容
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐![]() (用
(用![]() 代表)。回答下列问题:
代表)。回答下列问题:
(1)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(![]() )。第二周期部分元素的
)。第二周期部分元素的![]() 变化趋势如图(a)所示,其中除氮元素外,其他元素的
变化趋势如图(a)所示,其中除氮元素外,其他元素的![]() 自左而右依次增大的原因是__________;氮元素的
自左而右依次增大的原因是__________;氮元素的![]() 呈现异常的原因是_________。
呈现异常的原因是_________。
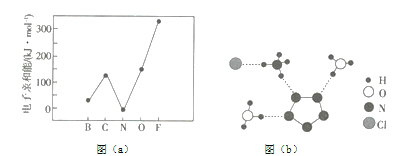
(2)经![]() 射线衍射测得化合物
射线衍射测得化合物![]() 的晶体结构,其局部结构如图(b)所示。
的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,![]() 中两种阳离子的相同之处为__________,不同之处为__________。(填标号)
中两种阳离子的相同之处为__________,不同之处为__________。(填标号)
A 中心原子的杂化轨道类型 B 中心原子的价层电子对数
C 立体结构 D 共价键类型
②![]() 中阴离子
中阴离子![]() 中的键总数为__________个。分子中的大
中的键总数为__________个。分子中的大![]() 键可用符号表示
键可用符号表示![]() ,其中
,其中![]() 代表参与形成大
代表参与形成大![]() 键的原子数,
键的原子数,![]() 代表参与形成大
代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() )则
)则![]() 中的大
中的大![]() 键应表示为__________。
键应表示为__________。
③图(b)中虚线代表氢键,其表示式为![]() 、__________、__________。
、__________、__________。
【答案】同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大 ![]() 原子的
原子的![]() 轨道为半充满状态,具有额外稳定性,故不易结合一个电子 ABD C 5
轨道为半充满状态,具有额外稳定性,故不易结合一个电子 ABD C 5 ![]()
![]() )
) ![]() )
)
【解析】
(1)从图(a)可以看出:除![]() 外,同周期元素随核电荷数依次增大,
外,同周期元素随核电荷数依次增大,![]() 逐渐增大,这是因为随原子半径逐渐减小,结合一个电子需要释放出更多的能量;
逐渐增大,这是因为随原子半径逐渐减小,结合一个电子需要释放出更多的能量;![]() 原子的
原子的![]() 轨道处于半充满状态,不易再结合一个电子,所以
轨道处于半充满状态,不易再结合一个电子,所以![]() 呈现异常,故答案为:同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大;
呈现异常,故答案为:同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大;![]() 原子的
原子的![]() 轨道为半充满状态,具有额外稳定性,故不易结合一个电;
轨道为半充满状态,具有额外稳定性,故不易结合一个电;
(2)①结合图(b)可知:晶体![]() 中两种阳离子为
中两种阳离子为![]() 和
和![]() ,两种阳离子的中心原子均采取
,两种阳离子的中心原子均采取![]() 杂化;
杂化;![]() 中成键电子对数为4,
中成键电子对数为4,![]() 中含1个孤电子对和3个成键电子对,即中心原子的价层电子对数均为4;两种阳离子中均存在极性键,不存在非极性键;
中含1个孤电子对和3个成键电子对,即中心原子的价层电子对数均为4;两种阳离子中均存在极性键,不存在非极性键;![]() 和
和![]() 分别为正四面体结构和三角锥形结构,即立体结构不同,故答案为:ABD;C;
分别为正四面体结构和三角锥形结构,即立体结构不同,故答案为:ABD;C;
②从图(b)可以看出:阴离子![]() 呈五元环状结构,其含有的
呈五元环状结构,其含有的![]() 键总数为5个;
键总数为5个;![]() 中参与形成大
中参与形成大![]() 键的电子数为6所以可将其中的大
键的电子数为6所以可将其中的大![]() 键表示为
键表示为![]() ,故答案为:5;
,故答案为:5;![]() ;
;
③从图(b)可以看出,铵根中氢原子与氯原子之间存在氢键,表示为![]() ,水合氢离子中的氢原子和
,水合氢离子中的氢原子和![]() 中的氮原子存在氢键,表示为
中的氮原子存在氢键,表示为![]() ),铵根中的氢原子和
),铵根中的氢原子和![]() 中的氮原子存在氢键,表示为
中的氮原子存在氢键,表示为![]() ),故答案为:
),故答案为:![]() );
);![]() )。
)。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】表中是元素周期表的一部分,回答下列有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素符号:①_______,⑥_______,⑦_______,_________。
(2)在这些元素形成的单质中,最活泼的金属单质是_____________,最活泼的非金属单质是_________(用化学符号做答)。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是(填化学式,下同)____________,碱性最强的是____________,呈两性的是___________,以上三者之间相互反应的化学方程式:________________________;________________________;________________________
(4)在④与⑤形成的单质中,化学性质较活泼的是____________(填名称),设计两个原理不同的简单实验。
方案一:________________________________________________;
方案二:________________________________________________。
(5)在⑦与⑧形成的单质中,化学性质较活泼的是____________,写出可以证明该结论的一个离子反应方程式________________________。