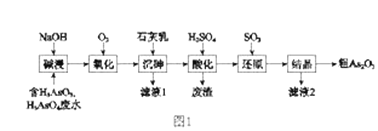
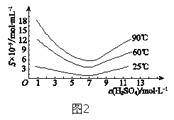
题目内容
【题目】下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.氢气的燃烧热为285.8 kJ·mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1
C.Ba(OH)2·8H2O(s)+2NH4Cl(s)= BaCl2(s)+2NH3(g)+10H2O(l) ΔH<0
D.已知中和热为57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的 稀溶液混合,则放出的热量大于57.3 kJ
【答案】C
【解析】
A.硫蒸汽所含能量比硫固体高,所以,等物质的量的硫蒸汽和硫固体分别完全燃烧,前者放出热量多,选项A错误;
B.氢气的燃烧热为285.8kJmol-1,氢气的燃烧热热化学方程式为:H2(g)+![]() O2(g)=H2O(l)△H=-285.8 kJ/mol,选项B错误;
O2(g)=H2O(l)△H=-285.8 kJ/mol,选项B错误;
C.反应中固体生成气体,△S>0,在常温下能自发进行,△G=△H-T△S<0,故ΔH<0,选项C正确;
D.已知中和热为57.3kJmol-1,若将含0.5molH2SO4的浓硫酸溶液与含1mol NaOH的溶液混合,由于浓硫酸溶解会放出热量,所以放出的热量要大于57.3kJ,选项D错误;
答案选C。

 阅读快车系列答案
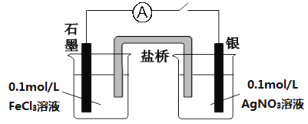
阅读快车系列答案【题目】某同学进行SO2的性质实验。在点滴板a、b、c、d处分别滴有不同的试剂,再向Na2SO3固体上滴加数滴浓H2SO4后,在整个点滴板上盖上培养皿,一段时间后观察到的实验现象如表所示。下列说法正确的是( )
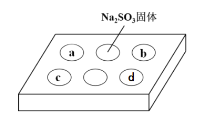
序号 | 试剂 | 实验现象 |
a | 品红溶液 | 红色褪去 |
b | 酸性KMnO4溶液 | 紫色褪去 |
c | NaOH溶液(含2滴酚酞) | 红色褪去 |
d | H2S溶液 | 黄色浑浊 |
A.在浓硫酸与Na2SO3固体反应中,浓硫酸表现的强氧化性
B.a、b均表明SO2具有漂白性
C.c中只可能发生反应:SO2+2OH-=SO32-+H2O
D.d中表明SO2具有氧化性
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___。已知:K1000℃>K800℃,则该反应是__反应。(填“吸热”或“放热”);
(2)已知在800℃时,该反应的平衡常数K1=0.9,则该温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K2=___。
CO2(g)+H2(g)的平衡常数K2=___。
(3)能判断该反应是否达到化学平衡状态的依据是__。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O),试判断此时的温度为__℃。