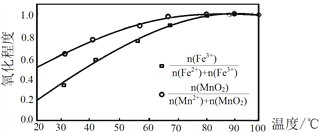
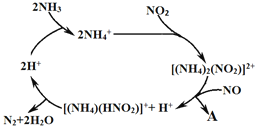
��Ŀ����
����Ŀ�����ݻ�Ϊ1.00 L�������У�ͨ��һ������N2O4��������ӦN2O4(g)![]() 2NO2(g)�����¶����ߣ�����������ɫ���
2NO2(g)�����¶����ߣ�����������ɫ���
�ش��������⣺
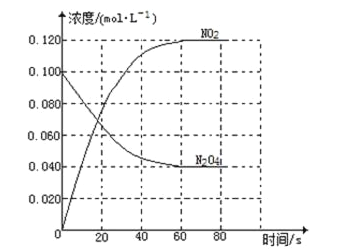
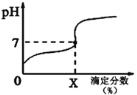
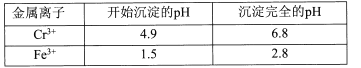
��1����Ӧ�Ħ�H___0������ڡ���С�ڡ�����100��ʱ����ϵ�и�����Ũ����ʱ��仯����ͼ��ʾ����0~60 sʱ�Σ���Ӧ����v(N2O4)Ϊ______mol��L-1��s-1����Ӧ��ƽ�ⳣ��K1Ϊ________mol��L-1��
��2��100 ��ʱ�ﵽƽ��ı䷴Ӧ�¶�ΪT��N2O4��0.0020 mol��L-1��s-1��ƽ�����ʽ��ͣ���10 s�ִﵽƽ�⡣��T_______100 �棨����ڡ���С�ڡ�����
���𰸡����� 0.001 0.36 mol��L-1 ����
��������
��1�����¶�������������ɫ���˵����Ӧ������NO2�ķ����ƶ�����������Ӧ�����ƶ�����������ӦΪ���ȷ�Ӧ������H>0������v=��c/��t���㣻��������ʽ����ƽ�ⳣ��K1��
��2��ƽ��������Ӧ�����ƶ���������������ԭ�����¶����ߣ������ȷ�Ӧ�����ƶ�����������Ӧ�����ƶ�����T>100����
��1�������⼰ͼʾ֪����1.00L�������У�ͨ��0.100mol��N2O4��������Ӧ��N2O4(g)![]() 2NO2(g)�����¶�������������ɫ���˵����Ӧ������NO2�ķ����ƶ�����������Ӧ�����ƶ�����������ӦΪ���ȷ�Ӧ������H>0����ͼʾ֪60sʱ�÷�Ӧ�ﵽƽ�⣬����N2O4Ϊ0.100mol��L-1��0.040mol��L-1��0.060mol��L-1������v=��c/��t��֪��v(N2O4)= 0.060mol��L-1/60s��0.0010mol��L-1��s-1��
2NO2(g)�����¶�������������ɫ���˵����Ӧ������NO2�ķ����ƶ�����������Ӧ�����ƶ�����������ӦΪ���ȷ�Ӧ������H>0����ͼʾ֪60sʱ�÷�Ӧ�ﵽƽ�⣬����N2O4Ϊ0.100mol��L-1��0.040mol��L-1��0.060mol��L-1������v=��c/��t��֪��v(N2O4)= 0.060mol��L-1/60s��0.0010mol��L-1��s-1��
��ƽ�ⳣ������������ʽ��
N2O4(g)![]() 2NO2(g)
2NO2(g)
��ʼ��/(mol��L-1) 0.100 0
ת����/(mol��L-1) 0.060 0.120
ƽ����/(mol��L-1) 0.040 0.120
K1=c2��NO2��/c��N2O4��=��0.120mol��L-1��2/0.040mol��L-1=0.36mol��L-1��
�ʴ�Ϊ��������0.001��0.36 mol��L-1��
(2)100��ʱ��ƽ��ı䷴Ӧ�¶�ΪT��N2O4��0.0020mol��L-1��s-1��ƽ�����ʽ��ͣ���10s�ִﵽƽ�⣬˵��ƽ��N2O4(g)![]() 2NO2(g)������Ӧ�����ƶ���������������ԭ�����¶����ߣ������ȷ�Ӧ�����ƶ�����������Ӧ�����ƶ�����T>100����
2NO2(g)������Ӧ�����ƶ���������������ԭ�����¶����ߣ������ȷ�Ӧ�����ƶ�����������Ӧ�����ƶ�����T>100����
�ʴ�Ϊ��������