题目内容
【题目】蜂胶是一种天然抗癌药,主要活性成分为咖啡酸苯乙酯(J)。合成化合物I的路线如下:

已知:①
②RCHO+HOOCCH2COOH![]() RCH=CHCOOH
RCH=CHCOOH
③当羟基与双键碳原子相连时,易发生转化:RCH-CHOH=RCHCHO
请回答下列问题:
(l)化合物F的名称是____;B-C的反应类型是____。
(2)化合物E中含氧官能团的名称是____;G-H的反应所需试剂和条件分别是____、____。
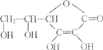
(3)写出化合物C与新制Cu(OH)2悬浊液反应的化学方程式____。
(4)化合物W与E互为同分异构体,两者所含官能团种类和数目完全相同,且苯环上有3个取代基,则W可能的结构有____种(不考虑顺反异构),其中核磁共振氢谱显示有6种不同化学环境的氢,峰面积比为2:2:1:1:1:1,写出符合要求的W的结构简式____。
(5)参照上述合成路线,设计由CH3CH=CH2和HOOCCH2COOH为原料制备 CH3CH2CH=CHCOOH的合成路线(无机试剂任选)____。
【答案】苯乙烯 取代反应 羟基、羧基 氢氧化钠水溶液 加热 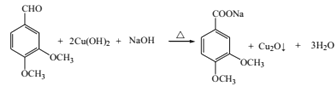 11
11 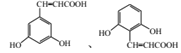

【解析】
根据已知①,A和H2O2反应生成B,结合C的结构简式可推知B的结构简式为![]() ;B发生取代反应生成C;根据已知②,在吡啶,加热条件下,C转化为D,由C的结构可推出D的结构简式为
;B发生取代反应生成C;根据已知②,在吡啶,加热条件下,C转化为D,由C的结构可推出D的结构简式为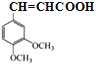 ;F和HBr在过氧化物存在的条件下发生加成反应生成G,G的结构简式为
;F和HBr在过氧化物存在的条件下发生加成反应生成G,G的结构简式为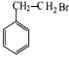 ;G水解生成H,H为醇,E为羧酸,在浓硫酸,加热条件下E和H发生酯化反应生成I,由I的结构可推知E的结构简式为
;G水解生成H,H为醇,E为羧酸,在浓硫酸,加热条件下E和H发生酯化反应生成I,由I的结构可推知E的结构简式为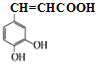 ,D→E为取代反应,以此分析解答。
,D→E为取代反应,以此分析解答。
(l)由F的结构简式可知,化合物F的名称是苯乙烯;B→C是![]() 转化为
转化为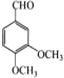 的反应,羟基上的氢原子被甲基取代,则反应类型是取代反应,
的反应,羟基上的氢原子被甲基取代,则反应类型是取代反应,
故答案为:苯乙烯;取代反应;
(2) E的结构简式为 ,则E中含氧官能团的名称是羟基、羧基;G→H是卤代烃的水解反应,所需试剂和条件分别是氢氧化钠水溶液、加热,
,则E中含氧官能团的名称是羟基、羧基;G→H是卤代烃的水解反应,所需试剂和条件分别是氢氧化钠水溶液、加热,
故答案为:羟基、羧基;氢氧化钠水溶液、加热;
(3) ![]() 分子中含有醛基,与新制Cu(OH)2悬浊液反应醛基被氧化产生砖红色沉淀,化学方程式为
分子中含有醛基,与新制Cu(OH)2悬浊液反应醛基被氧化产生砖红色沉淀,化学方程式为 ,
,
故答案为: ;
;
(4) E的结构简式为 ,化合物W与E互为同分异构体,两者所含官能团种类和数目完全相同,且苯环上有3个取代基,则W可能的结构有:
,化合物W与E互为同分异构体,两者所含官能团种类和数目完全相同,且苯环上有3个取代基,则W可能的结构有:![]() 、
、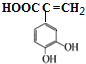 、
、![]() 、
、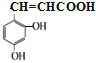 、
、![]() 、
、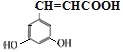 、
、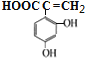 、
、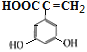 、
、![]() 、
、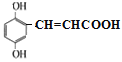 、
、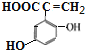 共11种;其中核磁共振氢谱显示有6种不同化学环境的氢,峰面积比为2:2:1:1:1:1,写出符合要求的W的结构简式
共11种;其中核磁共振氢谱显示有6种不同化学环境的氢,峰面积比为2:2:1:1:1:1,写出符合要求的W的结构简式 ;
;
故答案为:11; ;
;
(5) 要制备CH3CH2CH=CHCOOH,根据已知②,可用丙醛CH3CH2CHO与HOOCCH2COOH在吡啶,加热条件下反应制得,结合所提供的原料,只需完成由CH3CH=CH2合成丙醛即可,具体设计的合成路线为: ,
,
故答案为: 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案