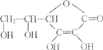
题目内容
【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如下图所示。

已知:I 在酸性条件下,H2O2能将Cr2O72-还原为Cr3+
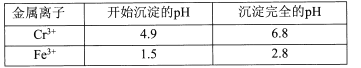
II相关金属离子形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(l)滤渣②的主要成分为____(填化学式)。
(2)写出“氧化”步骤中反应的化学方程式____。
(3)“加热”操作的目的是____。
(4)“酸化”过程中发生反应2CrO42-+2H+![]() Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=____
Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=____
(5)“结晶”后得到K2Cr2O7(M=294g.mol-1)产品0.5000 g,将其溶解后用稀H2SO4酸化,再用浓度为1.0000 mol.L-l (NH4)2Fe(SO4)2 标准溶液滴定,滴定终点消耗标准溶液的体积为9.00 mL,则产品的纯度为____。[滴定反应为:K2Cr2O7+6(NH4)2Fe(SO4)2+7H2SO4 =K2SO4 +Cr2(SO4)3 +6(NH4)2SO4+3Fe2(SO4)3+7H2O]
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如下图所示。

①负极的电极反应式为____;
②一段时间后,中间室中NaCl溶液的浓度____(填“增大”、“减小”或“不变”)。
【答案】Fe(OH)3 2Cr(OH)3+3H2O2+4KOH=2K2CrO4+8H2O 分解除去过量H2O2 2![]() 10-8mol/L 88.20% C6H5OH+11H2O-28e-=6CO2↑+28H+ 减小
10-8mol/L 88.20% C6H5OH+11H2O-28e-=6CO2↑+28H+ 减小
【解析】
含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)加入KOH溶液调pH=7~8,生成Cr(OH)3和Fe(OH)3沉淀,过滤后得滤渣①为Cr(OH)3和Fe(OH)3;向滤渣①加入过量H2O2溶液和KOH溶液,Cr(OH)3在碱性条件下被氧化为K2CrO4进入溶液,经过滤除去滤渣②的主要成分为Fe(OH)3;滤液②经加热除去过量H2O2,冷却后酸化至pH=1,结晶析出K2Cr2O7晶体,以此分析解答。
(l)根据以上分析,滤渣②的主要成分为Fe(OH)3,
故答案为:Fe(OH)3;
(2)“氧化”步骤中Cr(OH)3在碱性条件下被H2O2氧化为K2CrO4,化学方程式为2Cr(OH)3+3H2O2+4KOH=2K2CrO4+8H2O,
故答案为:2Cr(OH)3+3H2O2+4KOH=2K2CrO4+8H2O;
(3) 根据题给信息,在酸性条件下,H2O2能将Cr2O72-还原为Cr3+,所以酸化之前,要除去H2O2,故 “加热”操作的目的是分解除去过量H2O2,
故答案为:分解除去过量H2O2;
(4) 2CrO42-+2H+![]() Cr2O72-+H2O ,K=
Cr2O72-+H2O ,K=![]() ,酸化后pH=1,c(H+)=0.1mol/L,c(Cr2O72-)=1.6×10-3mol/L,则溶液中c(CrO42-)=
,酸化后pH=1,c(H+)=0.1mol/L,c(Cr2O72-)=1.6×10-3mol/L,则溶液中c(CrO42-)=![]() =2
=2![]() 10-8mol/L,
10-8mol/L,
故答案为:2![]() 10-8mol/L;
10-8mol/L;
(5)根据反应关系:K2Cr2O7~6(NH4)2Fe(SO4)2,n(K2Cr2O7)=![]() n[(NH4)2Fe(SO4)2]=
n[(NH4)2Fe(SO4)2]=![]() ×1.0000 mol.L-l×0.009L=0.0015mol,则产品的纯度为
×1.0000 mol.L-l×0.009L=0.0015mol,则产品的纯度为![]() ×100%=88.20%,
×100%=88.20%,
故答案为:88.20%;
(6)①由图可知,负极发生氧化反应,C6H5OH失电子生成CO2,根据电子守恒、电荷守恒和原子守恒写出电极反应式为C6H5OH+11H2O-28e-=6CO2↑+28H+;
②负极产生的H+通过阳离子交换膜进入中间室,正极产生的OH-通过阴离子交换膜也进入中间室,H+和OH-中和生成水,溶液体积增大,NaCl溶液的浓度将减小。
故答案为:C6H5OH+11H2O-28e-=6CO2↑+28H+;减小。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案