��Ŀ����
����Ŀ����ˮ��������Ȼ���������ص��ƻ����ã�������ˮ��Ⱦ�����̲��ݻ���
��1��ij�����������ķ�ˮ�к���Fe2����Mn2+�Ƚ������ӣ����ù������[(NH4)2S2O8]������ȥ��
�ٹ��������Mn2+��Ӧ����MnO2�����ӷ���ʽΪ________________��
���¶���Fe2+��Mn2+�����̶�֮��Ĺ�ϵ��ͼ1��ʾ��
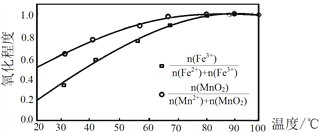
ͼ1
ʵ�������Ӧ���¶ȿ�����________________��Fe2+��Mn2+���������γɽ�����״���ӣ����������̿�������������̿��Ŀ��Ϊ________________��
��H2O2Ҳ�н�ǿ�����ԣ���ʵ�������в���H2O2����Mn2+��ԭ����________________��
��2������ij����ɸ��������NH3���ѳ�������NO��NO2���䷴Ӧ������ͼ2��ʾ��A�������ʵĻ�ѧʽΪN2��________________��
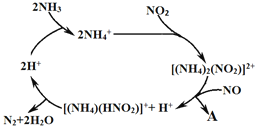

ͼ2 ͼ3
��3����ҵ�Ϸ�����SO2����Na2CO3��Һ���գ���Ӧ��������Һ��ɱ仯��ͼ3��ʾ��
�����ճ��ڣ�ͼ��A����ǰ����Ӧ�Ļ�ѧ����ʽΪ________________��
��C�����B���ԭ����________________��
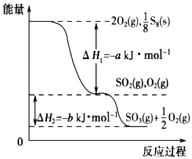
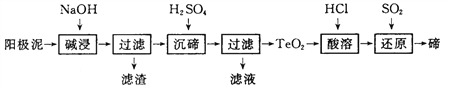
���𰸡� S2O82�� + 2H2O + Mn 2��=4H�� + 2SO42�� + MnO2�� 80����80��~90����������� �������������γɳ��� �̵Ļ�����ɴ�H2O2�ķֽ���ʹ���ĵ�H2O2���� H2O 2Na2CO3 + SO2 + H2O��2NaHCO3 + Na2SO3 ������Ԫ���غ��� NaHSO3�����ʵ�����Na2CO3��2��������NaHSO3�������������������ʹ�
����������1���ٹ��������Mn2+��Ӧ����MnO2������������ԭΪSO42������Ӧ�����ӷ���ʽΪS2O82�� + 2H2O + Mn 2��=4H�� + 2SO42�� + MnO2�����ڸ���ͼ1��֪��80��ʱFe2+��Mn2+�����̶Ƚӽ�1.0����ʵ�������Ӧ���¶ȿ�����80����Fe2+��Mn2+���������γɽ�����״���ӣ����������̿�������������̿��Ŀ��Ϊ�������������γɳ�������H2O2Ҳ�н�ǿ�����ԣ���ʵ�������в���H2O2����Mn2+��ԭ�����̵Ļ�����ɴ�H2O2�ķֽ���ʹ���ĵ�H2O2���ࣻ��2������ͼʾ��Ӧ�ɲ���A�ķ�ӦΪ��[��NH4����HNO2��]+=N2+A+H+����Ϸ�Ӧ���Ƶ���AΪH2O����ӦΪ[��NH4����HNO2��]+=N2+ 2H2O +H+����3�������ճ��ڣ�ͼ��A����ǰ����ҵ�Ϸ�����SO2����Na2CO3��Һ���գ���ͼ����Ϣ��֪��NaHCO3 ��Na2SO3�����������ӣ�������Ӧ�Ļ�ѧ����ʽΪ��2Na2CO3 + SO2 + H2O��2NaHCO3 + Na2SO3����C�����B���ԭ���Ǹ�����Ԫ���غ��� NaHSO3�����ʵ�����Na2CO3��2��������NaHSO3�������������������ʹ�

 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д� ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�