题目内容
16.某氢氧燃料电池是用金属铂作电极,以KOH溶液作电解质溶液,从两极分别通入H2和O2.下列对该燃料电池的叙述中正确的是( )| A. | 负极的电极反应式为:H2-2e-+2OH-═2H2O | |
| B. | H2应从负极通入,发生还原反应 | |
| C. | 标准状况下,通入5.6 L O2并完全反应后,有0.50 mol电子转移 | |
| D. | 放电一段时间后,通入O2的电极附近溶液的pH降低 |
分析 燃料原电池中,燃料失电子发生氧化反应,所以通入燃料的电极是负极,通入氧化剂的电极是正极,则通入氢气的电极是负极,电极反应式为H2-2e-+2OH-=2H2O,正极电极反应式为2H2O+O2+4e-=4OH-,根据电池反应式判断电子的转移以及溶液酸碱性的变化.
解答 解:A、燃料原电池中,氢气失电子发生氧化反应,氢气所在电极为负极,电极反应式为:H2-2e-+2OH-=2H2O,故A正确;
B、燃料氢气失电子发生氧化反应,故B错误;
C、正极反应为:2H2O+O2↑+4e-=4OH-,通入5.6L即0.25mol02并完全反应后,有1.00mol电子转移,故C错误;
D、通入02的电极反应为:2H2O+O2+4e-=4OH-,电极附近溶液的pH增大,故D错误.
故选A.
点评 本题考查了燃料电池,明确正负极上发生的反应类型及电解质反应式即可解答,难点是电极反应式的书写,要结合电解质溶液的酸碱性书写.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
7.2013年12月5日中国辽宁舰航母编队中的登陆舰紧急逼停了擅闯南海禁航区的美海军“考本斯”号导弹巡洋舰,避免了两军舰艇相撞.据悉,美国“考本斯”号巡洋舰上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)做载热介质.下列有关说法不正确的是( )
| A. | 自然界中没有游离的钠和铝 | |
| B. | 若铝钠合金投入水中得无色溶液,则n(Al)≤n(Na) | |
| C. | 铝钠合金投入到水中,一定有偏铝酸钠生成 | |
| D. | m g不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越小 |
11.水杨酸环已酯具有花香气味,可作为香精配方.其合成路线如图:
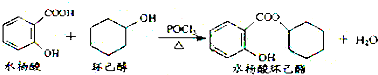
下列说法正确的是( )

下列说法正确的是( )
| A. | 水杨酸能分别与NaHCO3、Na2CO3溶液反应,且1 mol水杨酸分别消耗NaHCO32mol、Na2CO31mol | |
| B. | 水杨酸、环己醇和水杨酸环己酯均能与FeCl3溶液发生显色反应 | |
| C. | 1 mol水杨酸环己酯在NaOH溶液中水解时,最多消耗3 mol NaOH | |
| D. | 1 mol水杨酸跟足量浓溴水反应时,最多消耗Br2 2 mol |
8.已知反应X+Y═M+N为放热反应,下列有关说法正确的是( )
| A. | X的能量一定高于M | |
| B. | Y的能量一定高于N | |
| C. | X和Y的总能量一定高于M和N的总能量 | |
| D. | 因该反应为放热反应,所以一定不必加热就可 |
5.X、Y是原子序数大于4的两种主族元素,它们的离子Xm+ 和Yn- 具有相同的核外电子排布.有关X、Y的叙述不正确的是( )
| A. | 原子序数大小:X>Y | |
| B. | Xm+ 和Yn- 离子半径大小:r(Yn- )<r(Xm+) | |
| C. | 在周期表中X、Y在不同周期 | |
| D. | 在周期表中X、Y的族序数之差为:8-(m+n) |
6.下列物质分离提纯的方法不正确的是( )

| A. | 用工业酒精制无水乙醇选择装置③ | B. | 提纯含砂石的粗苯甲酸选择装置①② | ||
| C. | 从溴水中提纯溴选择装置④ | D. | 苯中混有少量溴苯选择装置③ |
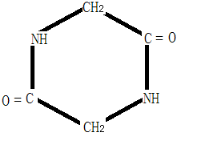 ,M与HCl反应的离子方程式为NH2CH2COOH+H+=
,M与HCl反应的离子方程式为NH2CH2COOH+H+=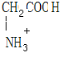 .
.