题目内容
6.(1)“纳米材料”特指粒径1~100nm(1nm=10-9 m)的颗粒,纳米材料和纳米技术的应用几乎涉及现代工业的各个领域.用纳米级的某种氧化物作催化剂,使汽车尾气中的CO跟NO反应转化为两种气体,其中一种可参与植物的光合作用,另一种是空气中含量最多的气体.两种气体是CO2、N2.写出NO和CO反应方程式2NO+2CO$\frac{\underline{催化剂}}{△}$2CO2+N2(2)在军事术语上把核潜艇在海里的连续航行叫长行.为了保证长时间潜行,在潜艇里要配备氧气的化学再生装置.制氧气方法有以下几种:①加热高锰酸钾 ②电解水 ③在常温下使过氧化钠(Na2O2)与二氧化碳反应生成碳酸钠和氧气 ④加热氧化汞.其中最适宜在潜艇里制氧气的方法是(填标号)③,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2↑、2Na2O2+2H2O=4NaOH+O2↑与其他几种方法相比该方法具有的优点是(至少写两点):①操作简单;②可吸收二氧化碳.
分析 (1)由题意知,用纳米级的某种氧化物作催化剂,使汽车尾气中的CO跟NO反应转化为两种气体,其中一种可参与植物的光合作用为二氧化碳,另一种是空气中含量最多的气体为氮气,依据反应原理、原子个数守恒找出反应物、生成物写成反应的化学方程式;
(2)在潜水艇中制备氧气,装置应简单易操作,反应物与生成物尽可能利用潜艇环境,能够循环利用,过氧化钠与水反应生成氢氧化钠和氧气,与二氧化碳反应生成碳酸钠和氧气,能够吸收人体呼出的二氧化碳,同时反应生成氧气供人体呼吸,据此解答.
解答 解:(1)二氧化碳参与光合作用,空气中含有氮气最多,一氧化碳与一氧化氮反应生成氮气和二氧化碳,化学方程式为:2NO+2CO$\frac{\underline{催化剂}}{△}$2CO2+N2;
故答案为:CO2;N2;2NO+2CO$\frac{\underline{催化剂}}{△}$2CO2+N2;
(2)高锰酸制备氧气需要加热,电解水需要加热,过氧化钠与水、二氧化碳反应制备氧气条件简单,且可以利用人类呼出的二氧化碳,反应的方程式:2Na2O2+2CO2=2Na2CO3+O2↑ 2Na2O2+2H2O=4NaOH+O2↑;
故答案为:③;2Na2O2+2CO2=2Na2CO3+O2↑、2Na2O2+2H2O=4NaOH+O2↑;操作简单;可吸收二氧化碳.
点评 本题考查了化学方程式的书写,明确发生反应实质是解题关键,注意制备氧气的多种方法的特点,题目难度不大.

练习册系列答案
相关题目
17.关于如图所示转化关系(X代表卤素),说法不正确的是( )
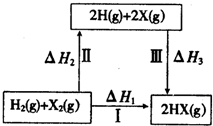

| A. | 2H(g)+2X(g)═2HX(g)△H3<0 | |
| B. | 途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3 | |
| C. | 途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定 | |
| D. | Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多 |
18.下列各醇中,能发生消去反应,且生成的烯烃只有一种的( )
| A. | CH3CH2CH(OH)CH3 | B. | CH3OH | C. | 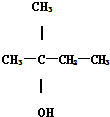 | D. |  |
15.甲烷和乙烯是两种重要的有机物,关于它们的说法不正确的是( )
| A. | 乙烯是重要的化工原料 | |
| B. | 甲烷和乙烯互为同系物 | |
| C. | 甲烷和乙烯可以用溴水加以鉴别 | |
| D. | 甲烷是最简单的有机物,是天然气的主要成分 |
16.某氢氧燃料电池是用金属铂作电极,以KOH溶液作电解质溶液,从两极分别通入H2和O2.下列对该燃料电池的叙述中正确的是( )
| A. | 负极的电极反应式为:H2-2e-+2OH-═2H2O | |
| B. | H2应从负极通入,发生还原反应 | |
| C. | 标准状况下,通入5.6 L O2并完全反应后,有0.50 mol电子转移 | |
| D. | 放电一段时间后,通入O2的电极附近溶液的pH降低 |
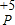 .
.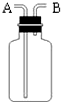 如图是化学中“有名”的装置(万能瓶),有如下用途:
如图是化学中“有名”的装置(万能瓶),有如下用途: