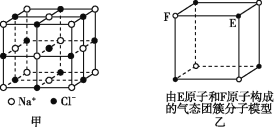
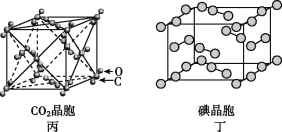
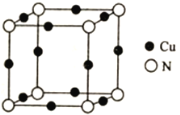
题目内容
【题目】(1)相对分子质量为72的烷烃,此烷烃的分子式为__;
(2)乙醇的官能团名称为___;
(3)苯与液溴取代反应的化学方程式__;
(4)乙醇与乙酸酯化反应的化学方程式__。
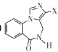
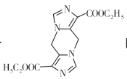
【答案】C5H12 羟基 ![]() +Br2
+Br2![]() +HBr CH3COOH+CH3CH2OH
+HBr CH3COOH+CH3CH2OH![]() C2H5OOCCH3+H2O
C2H5OOCCH3+H2O
【解析】
(1)烷烃的分子通式为CxH(2x+2),则14x+2=72,解得x=5,所以该烷烃的分子式为C5H12;
(2)乙醇的官能团名称为羟基;
(3)苯与液溴在溴化铁的催化作用下发生取代反应,化学方程式为![]() +Br2
+Br2![]() +HBr;
+HBr;
(4)乙醇和乙酸在浓硫酸加热的作用下生成乙酸乙酯,化学方程式为CH3COOH+CH3CH2OH![]() C2H5OOCCH3+H2O
C2H5OOCCH3+H2O

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)CO还原NO的反应为2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)H=-746kJ·mol-1。
2CO2(g)+N2(g)H=-746kJ·mol-1。
写出两条有利于提高NO平衡转化率的措施______________、______________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
H。恒容恒温条件下,向体积相同的甲、乙、丙三个容器中分别加入足量的焦炭和一定量的NO,测得各容器中NO的物质的量[n(NO)]随反应时间(t)的变化情况如表所示:
t/min n(NO)/mol 容器 | 0 | 40 | 80 | 120 | 160 |
甲/400℃ | 2.00 | 1.5 | 1.10 | 0.80 | 0.80 |
乙/400℃ | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
丙/T℃ | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①H______________0(填“>”或“<”);
②乙容器在160min时,v正_________v逆(填“>”、“<”或“=”)。
(3)某温度下,向体积为2L的恒容真空容器中通入2.0molNO2,发生反应:2NO2(g)![]() N2O4(g)H=-57.0kJ·mol-1,已知:v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数。测得NO2的体积分数[x(NO2)]与反应时间(t)的关系如表:
N2O4(g)H=-57.0kJ·mol-1,已知:v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数。测得NO2的体积分数[x(NO2)]与反应时间(t)的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 |
x(NO2) | 1.0 | 0.75 | 0.52 | 0.50 | 0.50 |
①![]() 的数值为______________;
的数值为______________;
②已知速率常数k随温度升高而增大,则升高温度后k1增大的倍数___________k2增大的倍数(填“>”、“<”或“=”)。
(4)用间接电化学法除去NO的过程,如图所示:
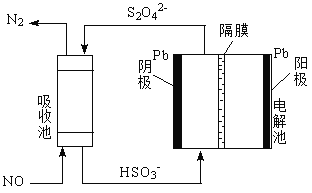
①已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:______________;
②用离子方程式表示吸收池中除去NO的原理:______________。
【题目】在800℃2L密闭容器中,反应2NO+O2![]() 2NO2,n(NO)随时间的变化如下表:
2NO2,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示各物质浓度的变化曲线。

A点处,v(正)__v(逆),A点正反应速率__B点正反应速率。(用“>”、“<”、“=”填空)
(2)图中表示O2变化的曲线是__。用NO2表示从0~2s内该反应的平均速率v=__。
(3)能使该反应的反应速率增大的是__。
A.及时分离出NO2气体 B.升高温度
C.减小O2的浓度 D.选择高效的催化剂
(4)能说明该反应已经达到平衡状态的是__。
A.容器内压强保持不变 B.v(NO)=2v(O2)
C.容器内的密度保持不变 D.v逆(NO2)=2v正(O2)