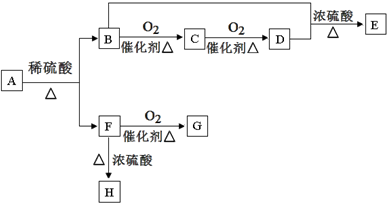
题目内容
13.X、Y均为短周期元素,X原子的最外层有3个电子,Y原子的最外层有6个电子,这两种元素形成的化合物的化学式是( )| A. | XY2 | B. | X2Y3 | C. | X2Y | D. | XY |
分析 元素的原子最外层有3个电子,所以易失电子,化合价为+3价,Y元素的原子最外层有6个电子,易得2个电子,化合价为-2价,再根据化合价书写化学式.
解答 解:由题意可知:X元素的原子最外层有3个电子,所以易失电子,化合价为+3价,Y元素的原子最外层有6个电子,易得2个电子,化合价为-2价,
根据化合价来书写化学式,一般正价在前,负价在后,化合物中正负化合价的代数和为0,
则该化合物的化学式是X2Y3.
故选B.
点评 本题考查了根据原子的最外层电子数(通常>4个的得电子,<4个的失电子)判断元素的化合价,及书写化学式的能力,比较基础.

练习册系列答案
相关题目
3.工业上制取CuCl2的生产流程如图:
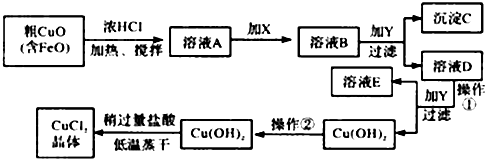
请结合表数据,回答下列问题:
①溶液A中加入X是一种“绿色”氧化剂,则X是NaClO(填化学式),其目的是氧化Fe2+生成Fe3+ 有利于沉淀分离.
②在溶液B中加入试剂Y常见的有:CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等,调节PHB,(A.PH≥9.6 B.PH 3~4 C.PH≥6.4)其作用是使Fe3+完全转变为氢氧化铁沉淀而分离Fe3+
③往Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2.采用“稍多量盐酸”和“低温蒸干”的目的是抑制 Cu2+水解.

请结合表数据,回答下列问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
②在溶液B中加入试剂Y常见的有:CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等,调节PHB,(A.PH≥9.6 B.PH 3~4 C.PH≥6.4)其作用是使Fe3+完全转变为氢氧化铁沉淀而分离Fe3+
③往Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2.采用“稍多量盐酸”和“低温蒸干”的目的是抑制 Cu2+水解.
4.下列关于有机物的说法错误的是( )
| A. | CCl4可由CH4反应得到,可萃取碘水中的碘 | |
| B. | 石油和天然气的主要成分都是碳氢化合物 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| D. | 证明CH3CH2CH=CHCH2CHO分子中有碳碳不饱和键的方法:向其中加酸性高锰酸钾溶液,高锰酸钾溶液褪色 |
1.下列5种烃:①2-甲基戊烷 ②2,2-二甲基丙烷 ③己烷 ④庚烷 ⑤戊烷,按它们的沸点由高到低的顺序排列正确的是( )
| A. | ①>②>③>④>⑤ | B. | ②>③>⑤>④>① | C. | ④>③>②>①>⑤ | D. | ④>③>①>⑤>② |
5.下列说法或表示方法正确的是( )
| A. | 反应物的总能量低于生成物的总能量时,该反应在常温下一定不能发生 | |
| B. | 已知C(s)+CO2(g)═2CO(g);△H1和C(s)+$\frac{1}{2}$O2(g)═CO(g);△H2,则△H1<△H2 | |
| C. | 已知:2SO2 (g)+O2 (g)?2SO3 (g);△H=-98.3kJ/mol.将1mol SO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量 | |
| D. | 由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s);△H<0 |
2.实验室下列物质的保存方法中,不正确的是( )
| A. | 铝片放在不密封的容器里 | |
| B. | 氢氧化钠溶液盛装在用玻璃塞的试剂瓶中 | |
| C. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 金属钠保存在石蜡油或煤油中 |
3.设NA表示阿伏加德罗常数,下列说法不正确的是( )
| A. | 1.7克氢氧根离子(OH-)含有的电子数为 NA | |
| B. | 7克乙烯(CH2=CH2)所含的电子数为4NA | |
| C. | 标准状况下,22.4L一氧化碳所含的分子数为 NA | |
| D. | 1molFe分别与氯气和硫反应失去电子都是3NA |