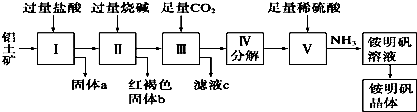
题目内容
12.(1)25℃时,水的离子积常数KW为1.0×10-14;在pH=2的稀硫酸中,c(OH-)=1×10-12mol/L;若升高温度,会使KW数值增大(填“增大”、“减小”或“不变”).(2)在醋酸水溶液中存在平衡CH3COOH?CH3COO-+H+.若分别改变下列条件:①加水稀释 ②加热 ③加少量固体醋酸钠,其中能使醋酸电离程度增大的是①②,能使溶液pH增大的是①③.(填序号)
分析 (1)依据溶液中离子积常数计算氢氧根离子浓度,水的电离是吸热过程,加热促进电离;
(2)醋酸存在电离平衡CH3COOH?H++CH3COO-,根据电离平衡移动的影响因素来分析.
解答 解:(1)25℃时,水的离子积常数KW为1.0×10-14;在pH=2的稀硫酸中,c(H+)=10-2mol/L,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-2}}$=10-12mol/L,水的电离是吸热过程,加热促进电离,若升高温度,会使KW数值增大;
故答案为:1×10-12mol/L;增大;
(2)醋酸存在电离平衡CH3COOH?H++CH3COO-,电离过程为吸热过程,加热、加水稀释、加入碱性物质均能使电离平衡向右移动,醋酸电离程度增大的是:①加水稀释;②加热;
能使溶液pH增大,氢离子浓度减小:①加水稀释氢离子浓度减小,溶液pH增大;②加热促进电离氢离子浓度增大,pH减小;③加少量固体醋酸钠,醋酸根离子浓度增大,抑制醋酸电离,氢离子浓度减小,pH增大;
故答案为:①②;①③.
点评 本题考查学生有关弱电解质的电离和离子浓度大小比较的知识,电离平衡影响因素分析判断,离子积常数的计算应用,难度中等.

练习册系列答案
相关题目
2.实验室下列物质的保存方法中,不正确的是( )
| A. | 铝片放在不密封的容器里 | |
| B. | 氢氧化钠溶液盛装在用玻璃塞的试剂瓶中 | |
| C. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 金属钠保存在石蜡油或煤油中 |
3.设NA表示阿伏加德罗常数,下列说法不正确的是( )
| A. | 1.7克氢氧根离子(OH-)含有的电子数为 NA | |
| B. | 7克乙烯(CH2=CH2)所含的电子数为4NA | |
| C. | 标准状况下,22.4L一氧化碳所含的分子数为 NA | |
| D. | 1molFe分别与氯气和硫反应失去电子都是3NA |
20.已知:①能量越低的物质越稳定;②白磷转化成红磷是放热反应.据此,下列判断或说法中正确的是( )
| A. | 在相同的条件下,红磷比白磷稳定 | B. | 在相同的条件下,白磷比红磷稳定 | ||
| C. | 红磷和白磷的结构相同 | D. | 同物质的量的红磷比白磷能量高 |
7.以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)?2CO2(g)+H2O(l)△H=-1 300kJ•mol-1的说法中,正确的是( )
| A. | 当10NA个电子转移时,该反应放出1 300 kJ的能量 | |
| B. | 当1NA个水分子生成且为液体时,吸收1300 kJ的能量 | |
| C. | 当2NA个碳氧共用电子对生成时,放出1300 kJ的能量 | |
| D. | 当4NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
4.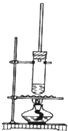 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图.下列对该实验的描述错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图.下列对该实验的描述错误的是( )
 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图.下列对该实验的描述错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图.下列对该实验的描述错误的是( )| A. | 控制温度不可以用水浴加热 | |
| B. | 长玻璃管起冷凝回流作用 | |
| C. | 提纯乙酸丁酯需要经过氢氧化钠溶液洗涤 | |
| D. | 加入过量乙酸可以提高1-丁醇的转化率 |
1.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1.7 g羟基(-OH)中含有的电子数为NA | |
| B. | 标准状况下,11.2 L CCl4含有的碳原子数为0.5NA | |
| C. | 1 mol苯分子中含有的碳碳双键数为3NA | |
| D. | 常温下,28g乙烯中含有的碳原子数为2NA |
3.实验室常利用甲醛(HCHO)法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mol (CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.
某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500g.
步骤Ⅱ将样品溶解在250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)上述操作步骤Ⅱ是否正确否(填“是”或“否”);若不正确,请改正将样品溶解在小烧杯中,冷却后转移至容量瓶中 (若正确,此空不填).
(2)根据步骤Ⅲ填空:
①该实验用的是50mL滴定管,如果液面处的读数是amL,则滴定管中液体的体积D(填代号)
A.是amL B.是(50-a)mL C.一定大于amlL D.一定大于(50-a)mlL②碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
③锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”、“偏小”或“无影响”)
④滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化.
⑤滴定达到终点时现象:溶液由无色变为粉红(或浅红)色,且半分钟内不变色.
(3)滴定结果如下表所示:
若NaOH标准溶液的浓度为0.1010mol•L-1,则该样品中氮的质量分数为18.85%.
某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500g.
步骤Ⅱ将样品溶解在250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)上述操作步骤Ⅱ是否正确否(填“是”或“否”);若不正确,请改正将样品溶解在小烧杯中,冷却后转移至容量瓶中 (若正确,此空不填).
(2)根据步骤Ⅲ填空:
①该实验用的是50mL滴定管,如果液面处的读数是amL,则滴定管中液体的体积D(填代号)
A.是amL B.是(50-a)mL C.一定大于amlL D.一定大于(50-a)mlL②碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
③锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”、“偏小”或“无影响”)
④滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化.
⑤滴定达到终点时现象:溶液由无色变为粉红(或浅红)色,且半分钟内不变色.
(3)滴定结果如下表所示:
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |