题目内容
【题目】下图为Zn-Cu原电池的示意图,请回答:
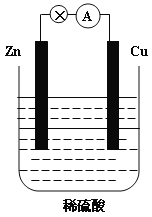
(1)锌片为原电池的______________(填“正”或“负”)极,该极的电极反应式是___________。该反应属于_______________(填“氧化”或“还原”)反应。
(2)__________(填“电子”或“电流”)从锌片通过导线流向铜片,溶液中H+的从_________(填“锌片”或“铜片”)获得电子。
(3)原电池工作一段时间后,H2SO4溶液的浓度_________(填“增大”或“减小”,下同),烧杯中溶液的质量__________。
(4)若锌片质量减轻6.5g,则另一极放出气体的体积为_________L(标准状况)。
【答案】负 Zn – 2e-= Zn2+ 氧化 电子 铜片 减小 增大 2.24
【解析】
(1)锌比铜活泼,锌片为原电池的负极,Zn发生氧化反应,电极反应式为Zn-2e-=Zn2+;故答案为负;Zn-2e-=Zn2+;氧化;
(2)原电池工作时,电子从锌片(负极)通过导线流向铜片(正极),铜为原电池的正极,发生还原反应,电极反应式为2H++2e-=H2↑,溶液中H+的从铜片获得电子;故答案为电子;铜片;
(3)电池总反应为Zn+2H+=Zn2++H2↑,由反应的方程式可知,原电池工作一段时间后,H2SO4溶液的浓度变小,溶液中每消耗2gH+,同时生成65gZn2+,烧杯中溶液质量增大;故答案为减小;增大;
(4)若锌片质量减轻6.5g,n(Zn)=6.5g÷65g/mol=0.1mol,根据电池总反应Zn+2H+=Zn2++H2↑,生成氢气物质的量为0.1mol,标准状况下体积为0.1mol×22.4L/mol=2.24L;故答案为2.24。

练习册系列答案
相关题目