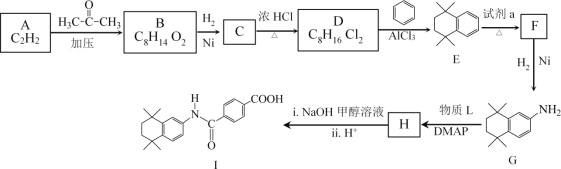
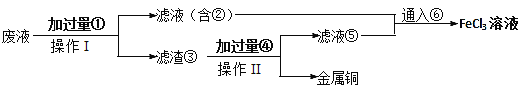
题目内容
【题目】将![]() 锌粒投入500mL 2mol/L的硫酸溶液中,试计算:
锌粒投入500mL 2mol/L的硫酸溶液中,试计算:
(1)产生的氢气在标准状况下的体积是__________;
(2)忽略溶液体积变化体积,反应后溶液中氢离子浓度是__________;
(3)要配制500mL 2mol/L的硫酸溶液,需用质量百分数为98%,密度为1.84g/cm3浓硫酸_______![]() 保留三位有效数字
保留三位有效数字![]() 。
。
【答案】6.72L ![]()
![]() mL
mL
【解析】
根据反应方程式![]() 可知反应65g锌,消耗1mol硫酸,生成22.4L氢气,19.5g锌参加反应,应消耗0.3mol硫酸,硫酸过量,生成6.72L氢气,剩余硫酸(1-0.3)=0.7mol,据此回答。
可知反应65g锌,消耗1mol硫酸,生成22.4L氢气,19.5g锌参加反应,应消耗0.3mol硫酸,硫酸过量,生成6.72L氢气,剩余硫酸(1-0.3)=0.7mol,据此回答。
⑴根据反应方程式可知反应65g锌,消耗1mol硫酸,生成22.4L氢气,19.5g锌参加反应,应消耗0.3mol硫酸,生成6.72L氢气,故答案为:6.72;
⑵剩余硫酸![]() ,
,![]()
![]() ,故答案为:
,故答案为:![]() 。
。
⑶根据浓度计算公式![]() ,
,![]() ,再根据稀释公式
,再根据稀释公式![]() 得
得![]()
![]() ,故答案为:54.3.
,故答案为:54.3.

练习册系列答案
相关题目