题目内容
【题目】考古发掘出的古代青铜器(含铜锡等金属)表面经常出现小孔腐蚀,这是一种电化学腐蚀现象。小孔腐蚀的过程及铜腐蚀产物(铜锈)的成份如下图所示:
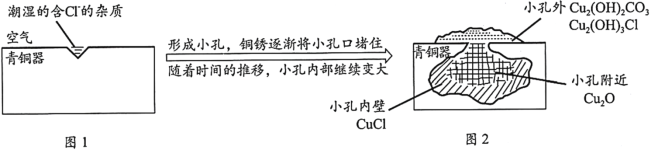
已知:2CuCl+H2O![]() Cu2O+2HCl
Cu2O+2HCl
下列分析不正确的是
A.氧气是正极反应物B.铜锈的成份与氧气浓度、pH有关
C.图2中,Cl-从小孔内向小孔外移动D.青铜中的锡也会发生电化学腐蚀
【答案】C
【解析】
A. 青铜器中含铜锡等金属,也含有其它金属及非金属杂质,由于物质活动性不同,周围有电解质溶液,形成了原电池,Cu为原电池的负极,失去电子发生氧化反应,由于电解质溶液为中性,发生吸氧腐蚀,正极上氧气得到电子,变为OH-,因此氧气是正极反应物,A正确;
B. 根据图2可知:在锈蚀小孔外物质成分为Cu2(OH)2CO3、Cu2(OH)3Cl,Cu元素化合价为+2价;在小孔附近物质是Cu2O,小孔内壁物质成分是CuCl,Cu元素化合价为+1价,小孔外氧气浓度大,Cu元素价态高,小孔内氧气浓度小,Cu元素价态低,物质成分与氧气浓度有关;在溶液酸性较强时可逆反应2CuCl+H2O![]() Cu2O+2HCl的平衡逆向移动,物质成分主要是CuCl,若溶液酸性弱,,平衡正向移动,物质成分主要是Cu2O,可见物质成分也与溶液的pH有关,B正确;
Cu2O+2HCl的平衡逆向移动,物质成分主要是CuCl,若溶液酸性弱,,平衡正向移动,物质成分主要是Cu2O,可见物质成分也与溶液的pH有关,B正确;
C. 溶液中微粒Cl-总是向低洼处流动,因此会从小孔外向小孔内移动,与氧气浓度较小时的+1价Cu形成难溶性固体CuCl, C错误;
D. 由于Sn是比较活泼的金属,因此也会与活动性比Sn弱的金属构成原电池,Sn为负极,被氧化而引起电化学腐蚀,D正确;
故合理选项是C。

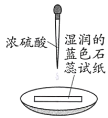
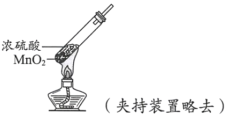
【题目】下列依据实验方案和现象对浓硫酸性质做出的判断合理的是
实验方案 | 实验I: | 实验II: |
实验现象 | 试纸中心区域变黑,边缘变红 | 黑色固体溶解,溶液接近无色(溶液中锰元素仅以 |
A.由I可知,浓硫酸具有脱水性B.由I可知,浓硫酸具有弱酸性
C.由II可知,浓硫酸具有强氧化性D.由II可知,浓硫酸具有吸水性