题目内容
【题目】Fe与Si形成的合金及铁的配合物用途非常广泛,回答下列问题:
(1)基态Fe2+核外价电子排布式为________;在基态Si原子中,核外存在_____对自旋方向相反的电子。
(2)Fe78Si9B13是一种非晶合金,可通过________方法区分晶体和非晶体。
(3)硅烯是一种具有石墨烯结构的新型二维材料,二硅烯Si2H4分子的几何构型为____,依据电子云的重叠方式可知其所含共价键类型是________。
(4)配合物[Fe(Htrz)3](ClO4) 2 (Htrz为![]() ,1,2,4-三氮唑)
,1,2,4-三氮唑)
①与Fe2+形成配位键的原子是_______;已知分子中的大![]() 键可用
键可用 ![]() 符号表示,其中m代表参与形成大
符号表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数,则配体
键的电子数,则配体![]() 中的大
中的大![]() 键应表示为_____
键应表示为_____
②1,2,4-三氮唑的沸点为260 ℃,环戊二烯(![]() )的沸点为42.5 ℃,前者的沸点比后者大得多,其原因是_____ 。
)的沸点为42.5 ℃,前者的沸点比后者大得多,其原因是_____ 。
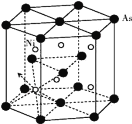
(5)砷化镍晶胞的结构如下图所示,1个砷化镍晶胞中含________个As;若六棱柱底边边长为a cm,高为c cm,阿伏加德罗数的值为NA,则砷化镍的密度为____g/cm3。
【答案】3d6 6 X射线衍射 平面形 ![]() 键和
键和![]() 键 N
键 N ![]() 1,2,4三氮唑分子间可形成氢键 6
1,2,4三氮唑分子间可形成氢键 6 
【解析】
(1) Fe2+是Fe原子失去最外层的2个电子形成的,根据构造原理可得基态Fe2+核外价电子排布式;先写出Si的核外电子排布式,根据一个原子轨道上最多容纳2个自旋方向相反的电子,结合各种轨道的数目,判断基态Si原子核外存在的自旋方向相反的电子对数;
(2)用X射线衍射实验区分晶体和非晶体;
(3)结合乙烯平面结构分析;非金属元素的原子之间通过共价键结合,根据原子之间形成的共价键数目判断共价键类型;
(4)①在配位键形成时,中心原子提供空轨道,配位体的原子提供孤电子对;根据配位体的结构确定其表示方法;
②分子之间形成氢键可增加分子之间的吸引作用;
(5)用均摊方法计算一个晶胞中含有的As、Ni原子数目,再利用密度计算公式计算晶胞密度。
(1)Fe是26号元素,基态Fe原子核外电子排布式是1s22s22p63s23p63d64s2,价层电子排布式是3d64s2,Fe原子失去最外层2个4s电子得到Fe2+,故基态Fe2+核外价电子排布式为3d6;Si是14号元素,基态Si原子中核外电子排布式是1s22s22p63s23p2,由于s轨道数目是1,p轨道数目是3,在一个原子轨道上最多容纳2个自旋方向相反的电子,且原子尽可能成单排列,而且自旋方向相同,这样原子的能量最低,处于稳定状态,则基态Si原子的核外存在的自旋方向相反的电子对数为6对;
(2)区分晶体与非晶体的方法是使用X射线衍射;
(3)C、Si是同一主族的元素,形成的化合物结构相似,由于CH2=CH2是平面结构,可推知二硅烯Si2H4分子也是平面结构,其结构简式是SiH2=SiH2;在物质分子中的共价单键都是![]() 键,共价双键中一个是
键,共价双键中一个是![]() 键,一个是
键,一个是![]() 键,故二硅烯中所含共价键类型是
键,故二硅烯中所含共价键类型是![]() 键和
键和![]() 键;
键;
(4)①在配合物[Fe(Htrz)3](ClO4)2中,Fe2+提供空轨道,配位体的N原子上含有孤电子对,因此在形成配位化合物时与Fe2+形成配位键的原子是N原子;在配位体![]() 中,参与形成大π键的原子数是5,参与形成大π键的电子数是6,所以可表示为
中,参与形成大π键的原子数是5,参与形成大π键的电子数是6,所以可表示为![]() ;
;
②1,2,4-三氮唑的沸点为260 ℃,而环戊二烯(![]() )的沸点为42.5 ℃,前者的沸点比后者大得多,是由于在1,2,4-三氮唑的分子中 N原子非金属性强,原子半径小,不同的分子之间形成了氢键,增加了分子之间的吸引作用,而在环戊二烯分子之间无氢键,因此前者熔沸点比后者高;
)的沸点为42.5 ℃,前者的沸点比后者大得多,是由于在1,2,4-三氮唑的分子中 N原子非金属性强,原子半径小,不同的分子之间形成了氢键,增加了分子之间的吸引作用,而在环戊二烯分子之间无氢键,因此前者熔沸点比后者高;
(5)根据图示可知As原子位于两个底面面心上各有1个,位于六棱柱12个顶点上个1个,在体内有3个,则该晶胞中含有的As原子数目为![]() ×12+
×12+![]() ×2+3=6;晶胞中含有的Ni原子数目为6个,则晶胞质量m=
×2+3=6;晶胞中含有的Ni原子数目为6个,则晶胞质量m=![]() g,若六棱柱底边边长为a cm,高为c cm,则晶胞体积为V=6×
g,若六棱柱底边边长为a cm,高为c cm,则晶胞体积为V=6×![]() a2c cm3,所以该晶胞的密度ρ=
a2c cm3,所以该晶胞的密度ρ=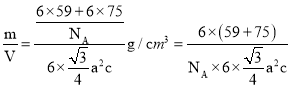 g/cm3。
g/cm3。