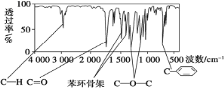
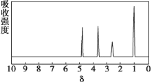
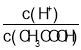题目内容
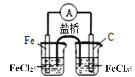
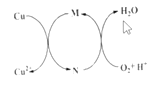
【题目】碱式氯化铜[CuaClb(OH)cH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应后生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示
步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。下列有关说法正确的是( )
A.a、b、c之间的关系式为:a=b+c
B.图中M、N分别为Fe2+、Fe3+
C.步骤1充分反应后,加入CuO是为了除去Fe3+
D.若制备1molCuCl2,理论上消耗11.2LO2
【答案】C
【解析】
A.化合物中正负化合价的代数和等于0,可知2a=b+c,A错误;
B.Fe3+对该反应有催化作用,可知M是Fe3+,N是Fe2+,B错误;
C.步骤1充分反应后的溶液中含催化剂Fe3+,Fe3+水解使溶液显酸性,CuO与H+反应产生Cu2+和水,当溶液的pH增大到一定程度,Fe3+完全转化为Fe(OH)3沉淀而除去,从而达到除去Fe3+的目的,C正确;
D.制备1molCuCl2,转移2mol电子,根据电子守恒,需要消耗0.5molO2,未给定氧气的条件,不能确定气体的体积,D错误;
答案为C。

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目