题目内容
15.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )| A. | 0.1 mol•L-1CH3COOH与0.1 mol•L-1氨水等体积混合(pH=7): c(NH4+)=c(CH3COO-)=c(H+)=c(OH-) | |
| B. | 0.1 mol•L-1HCl溶液与0.2 mol•L-1氨水等体积混合(pH>7): c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-) | |
| C. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1CaCl2溶液等体积混合: c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1 NaHCO3溶液等体积混合: c(HCO3-)>0.05 mol•L-1>c(CO32-)>c(OH-) |
分析 A.溶液为中性,则c(H+)=c(OH-),结合电荷守恒可得:c(NH4+)=c(CH3COO-),反应后溶液中氢离子、氢氧根离子浓度较小,则c(NH4+)=c(CH3COO-)>c(H+)=c(OH-);
B.反应后溶质为等浓度的氯化铵和一水合氨,混合液的pH大于7,则一水合氨的电离程度大于铵根离子的水解程度,再结合物料守恒判断各离子浓度大小;
C.根据混合液中的物料守恒判断;
D.碳酸根离子的水解程度大于碳酸氢根离子,则溶液中碳酸氢根离子的浓度增大、碳酸根离子浓度减小,即:c(HCO3-)>0.05 mol•L-1>c(CO32-).
解答 解:A.0.1 mol•L-1CH3COOH与0.1 mol•L-1氨水等体积混合,混合液的pH=7,则c(H+)=c(OH-),结合电荷守恒可得:c(NH4+)=c(CH3COO-),反应后溶液中氢离子、氢氧根离子浓度较小,则溶液中正确的离子浓度大小为:c(NH4+)=c(CH3COO-)>c(H+)=c(OH-),故A错误;
B.0.1 mol•L-1HCl溶液与0.2 mol•L-1氨水等体积混合(pH>7),反应后溶液中的溶质为等浓度的氯化铵和一水合氨,混合液的pH大于7,则一水合氨的电离程度大于铵根离子的水解程度,则c(NH4+)>c(NH3•H2O),根据物料守恒c(NH4+)+c(NH3•H2O)=2c(Cl-)可得:c(NH4+)>c(Cl-)>c(NH3•H2O),溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-),故B正确;
C.0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1CaCl2溶液等体积混合,根据物料守恒可得:c(Na+)+2c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-),故C错误;
D.0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1 NaHCO3溶液等体积混合,溶质碳酸钠和碳酸氢钠的物质的量相等,由于碳酸根离子的水解程度大于碳酸氢根离子,则溶液中碳酸氢根离子浓度大于碳酸根离子,即:c(HCO3-)>0.05 mol•L-1>c(CO32-),所以溶液中离子浓度大小为:c(HCO3-)>0.05 mol•L-1>c(CO32-)>c(OH-),故D正确;
故选BD.
点评 本题考查了离子浓度大小比较,题目难度中等,明确混合液中溶质组成为解答关键,注意掌握盐的水解原理、电荷守恒、物料守恒的含义及其应用方法,试题培养了学生灵活应用基础知识的能力.

 阅读快车系列答案
阅读快车系列答案| A. |  三甲苯 三甲苯 | B. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | ||
| C. | CH3CH(NH2)CH2COOH α-氨基丁酸 | D. | 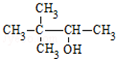 3,3-二甲基-2-丁醇 3,3-二甲基-2-丁醇 |
| A. | FeCl3溶液滴入热水中制Fe(OH)3胶体:Fe3++3OH-═Fe(OH)3(胶体) | |
| B. | ICl溶于冷的稀KOH溶液中:ICl+2OH-═Cl-+IO-+H2O | |
| C. | 用惰性电极电解CuSO4溶液:2Cu2++4OH-电解_2Cu↓+O2↑+2H2O | |
| D. | Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3−+Ca2++OH-═CaCO3↓+H2O |
| A. | 因为A2-+H2O?HA-+OH-,所以Na2A溶液显碱性 | |
| B. | 0.1 mol/L H2A溶液中氢离子的物质的量浓度为0.11 mol/L | |
| C. | NaHA溶液中各种离子浓度的关系是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 在NaHA溶液中,HA-电离的趋势大于其水解的趋势 |

| A. | 电解过程中,电子的流向由a→b→c→d | |
| B. | 电极b是正极,且反应后该电极区pH增大 | |
| C. | 燃料电池的总反应为:2Al+3HO2-=2AlO2-+OH-+H2O | |
| D. | 电解时,Al消耗2.7g,则产生氮气标准状况下为1.12L |
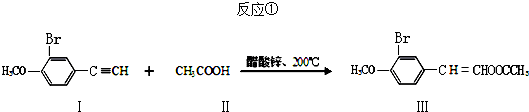
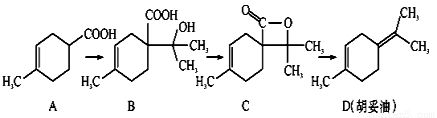
 (任写其中一种)
(任写其中一种) 涂料的单体,化合物Ⅴ单体结构简式为CH3COOCH=CHCH3.
涂料的单体,化合物Ⅴ单体结构简式为CH3COOCH=CHCH3. .利用类似反应①的方法,仅以丙炔和乙酸为有机物原料合成该单体,写出反应方程式
.利用类似反应①的方法,仅以丙炔和乙酸为有机物原料合成该单体,写出反应方程式 .
.
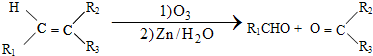
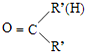
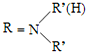 +H2O
+H2O +HNO3
+HNO3 +H2O
+H2O
 .(写出其中的一种的结构简式).
.(写出其中的一种的结构简式).

 .
.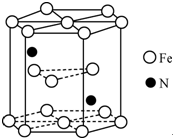 铁及其化合物在生产生活及科学研究方面应用非常广泛.
铁及其化合物在生产生活及科学研究方面应用非常广泛. .
.