题目内容
【题目】已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,回答下列有关问题:
(1)用0.1mol Ba(OH)2配成稀溶液与足量稀硝酸反应,能放出__________kJ的能量。
(2)如图所示装置中,仪器A的名称是_______________,作用是___________________________;碎泡沫塑料的作用是__________________________________。
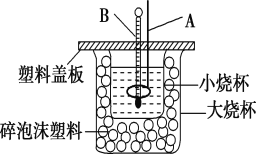
(3)通过实验测定的中和热的ΔH常常大于-57.3kJ/mol,其原因可能是______________。
【答案】11.46 环形玻璃搅拌棒 搅拌,使溶液充分混合 保温、隔热,减少实验过程中的热量损失 实验中不可避免有少量热量损失
【解析】
(1)0.1mol Ba(OH)2与足量的稀硝酸反应生成0.2mol水,根据H+(aq)+OH-(aq)═H2O(l) △H= -57.3 kJmol-1可知,生成1mol H2O放出热量为57.3kJ,然后根据水的物质的量与热量成正比求出热量;
(2)量热器是由大小烧杯、温度计、环形玻璃搅拌器、碎泡沫塑料和盖板构成;
(3)实验测定的中和热大于-57.3kJ,是由于操作过程中热量损失造成的。
(1)由H+(aq)+OH-(aq)═H2O(l) △H= -57.3kJmol-1可知生成1mol H2O放出热量为57.3kJ,而0.1mol Ba(OH)2配成稀溶液与足量稀硝酸反应可得0.2mol H2O,所以放出的热量为57.3kJ×0.2=11.46kJ;
(2)仪器A的名称是环形玻璃搅拌棒,作用是搅拌,使溶液充分混合;仪器B是温度计,作用是测量溶液的温度;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热,减少实验过程中的热量损失;
(3)实验中一定会有热量散失,求得的中和热数值将会减小,△H大于-57.3kJmol-1。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案