题目内容
【题目】汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)=2NO(g) ΔH>0 ,已知该反应在240℃,平衡常数K=6.4×10-3。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率为______________.
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志______________.
A. 消耗1mol N2同时生成1mol O2 B.混合气体密度不变
C. 混合气体平均相对分子质量不变 D.2v正(N2)=v逆(NO)
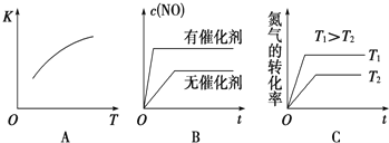
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是______![]() 填字母序号
填字母序号![]() 。
。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态![]() 与原平衡状态相比,此时平衡混合气中NO的体积分数___________
与原平衡状态相比,此时平衡混合气中NO的体积分数___________![]() 填“变大”、“变小”或“不变”
填“变大”、“变小”或“不变”![]()
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2 mol/L和3.0×10-3 mol/L,此时反应________________________![]() 填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”
填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”![]()
【答案】0.05mol/(L·min) AD AC 不变 向正反应方向进行
【解析】
(1)5分钟内,△n(O2)=1mol-0.5mol=0.5mol,由N2(g)+O2(g)2NO(g),可知△n(N2)=0.5mol,再根据![]() 计算v(N2);
计算v(N2);
(2)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(3)A.该反应的正反应为吸热反应,则升高温度平衡向正反应进行,平衡常数增大;
B.加入催化剂,反应速率增大,但平衡不发生移动;
C.升高温度,反应速率增大,平衡向正反应方向移动,氮气的转化率增大;
(4)达到平衡状态后再向其中充入一定量NO等效为在原平衡的基础上增大压强,反应前后气体的物质的量不变,平衡不移动,平衡时相同物质的体积分数相等;
(5)计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行。
(1)5分钟内,△n(O2)=1mol0.5mol=0.5mol,由N2(g)+O2(g)2NO(g)可知△n(N2)=0.5mol,v(N2)=![]() ═0.05 mol/(Lmin);
═0.05 mol/(Lmin);
(2)A. 消耗1mol N2等效于消耗1mol O2,同时生成1mol O2,到达平衡状态,A项正确;
B. 混合气体总质量不变,容器容积不变,混合气体密度始终不变,B项错误;
C. 混合气体总质量不变,反应前后气体物质的量不变,混合气体平均相对分子质量始终不变,C项错误;
D. 由方程式可知2v(N2)正=v(NO)正,而2v正(N2)=v逆(NO),则v正(NO)=v逆(NO),处于平衡状态,D项正确;
故答案选:AD;
(3)A.该反应的正反应为吸热反应,则升高温度平衡向正反应进行,平衡常数增大,A项正确;
B. 加入催化剂,反应速率增大,但平衡不发生移动,NO浓度不变,B项错误;
C. 升高温度,反应速率增大,平衡向正反应方向移动,氮气的转化率增大,C项正确,
故答案为:AC;
(4)达到平衡状态后再向其中充入一定量NO等效为在原平衡的基础上增大压强,反应前后气体的物质的量不变,平衡不移动,平衡时相同物质的体积分数相等,此时平衡混合气中NO的体积分数不变;
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×101mol/L、4.0×102mol/L和3.0×103mol/L,浓度商Qc=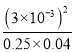 =9×104<K=64×104,则反应应向正反应方向进行。
=9×104<K=64×104,则反应应向正反应方向进行。

 名校课堂系列答案
名校课堂系列答案【题目】饮水安全在灾后重建中具有极其重要的地位,某研究小组提取三处被污染的水源进行了如下分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质、一处含有E物质,A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子 | K+ Na+ Cu2+ Al3+ |
阴离子 | SO |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B__,D__。
(2)将含1molA的溶液与含1molE的溶液充分反应,仅得到一种化合物,该化合物为__。(填化学式)
(3)写出实验②发生反应的离子方程式__。
(4)C常用作净水剂,用离子方程式表示其净水原理__。