题目内容
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)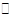 4NO2 +O2(g)△H>0,T1温度下的部分实验数据为:
4NO2 +O2(g)△H>0,T1温度下的部分实验数据为:
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol/L | 5.00 | 3.55 | 2.50 | 2.50 |
下列说法中,正确的是:
A.当反应体系内气体的平均相对分子质量不再发生变化时则该反应达到了平衡
B.T1温度下的平衡常数为K1=125,500s时N2O5的转化率为71%:
C.其他条件不变时,T2温度下反应到2000s时测得N2O5 (g)浓度为2.78mol/L, 则T1<T2
D.T1温度下的平衡常数为K1,若维持T1温度不变,增加体系压强,达到新的平衡时,平衡常数为K2,则K2>K1
A
解析试题分析: 2N2O5(g)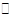 4NO2 +O2(g)△H>0
4NO2 +O2(g)△H>0
C始(mol/L) 5.00 0 0
C改变(mol/L) 2.50 5.0 2.5
C末(mol/L) 2.50 5.0 2.5
B.T1温度下的平衡常数为K1= =250,500s时N2O5的转化率为
=250,500s时N2O5的转化率为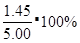 =29%:C.其他条件不变时,T2温度下反应到2000s时测得N2O5 (g)浓度为2.78mol/L,根据勒夏特列原理,应该采用了降温措施, T1>T2;D.化学平衡常数只跟温度有关,温度不变,化学平衡常数不变。
=29%:C.其他条件不变时,T2温度下反应到2000s时测得N2O5 (g)浓度为2.78mol/L,根据勒夏特列原理,应该采用了降温措施, T1>T2;D.化学平衡常数只跟温度有关,温度不变,化学平衡常数不变。
考点:考查化学平衡的移动和化学平衡常数的考查。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是
| A.该反应的热化学方程式为:ΔH>0 |
| B.若其它条件不变,升高温度,正、逆反应速率均增大,X的转化率减小 |
| C.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动 |
| D.达到平衡后,若其他条件不变,通人稀有气体,平衡向正反应方向移动 |
铁的氧化物可用于脱除煤气中的H2S,该反应原理为:
①Fe3O4 (s)+3H2S(g)+H2 (g) 3FcS(s)+4H2O(g) △H=a kJ ? mol-1
3FcS(s)+4H2O(g) △H=a kJ ? mol-1
②Fe2O3(s)+2H2S(g) + H2(g) 2FeS(s)+3H2O(g) △H=bkJ ? mol-1
2FeS(s)+3H2O(g) △H=bkJ ? mol-1
③FeO(s)+H2S(g)  FeS(s)+H2O(g) △H=ckJ· mol-1
FeS(s)+H2O(g) △H=ckJ· mol-1
温度与平衡常数的关系如图,下列有关说法正确的是
| A.a、b、c均小于0 |
| B.压强越大,H2S的脱除率越高 |
| C.温度越高,H2S的脱除率越高 |
| D.反应①、②、③的平衡常数表达式相同 |
900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: ΔH=a kJ·mol—1。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
ΔH=a kJ·mol—1。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
下列说法正确的是
A.反应在前20 min的平均速率为v(H2)=0.008mol·L-1·min-1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol·L-1,则a<0
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0%
D.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v正>v逆
一定温度下,在2L恒容密闭容器中发生反应:2N2O5(g) 4NO2(g)+ O2(g) △H﹥0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是
4NO2(g)+ O2(g) △H﹥0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是
| A.10min时,反应达到平衡 |
| B.达到平衡时N2O5的转化率为60% |
| C.0~20min内平均反应速率v(N2O5)=0.05mol?L-1?min-1 |
| D.曲线a表示NO2的物质的量随反应时间的变化 |
下列图示与对应的叙述相符的是 ( )
图1 图2 图3 图4
| A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示0.1000 mol·L-1NaOH溶液滴定20.00mL0.1000 mol·L-1CH3COOH溶液所得到的滴定曲线 |
| C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的饱和溶液 |
| D.图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v正 > v逆 |
在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
下列说法正确的是( )
| A.上述生成Ni(CO)4(g)的反应为吸热反应 |
B.25℃时反应Ni(CO)4(g)  Ni(s)+4CO(g)的平衡常数为0.5(mol·L-1)3 Ni(s)+4CO(g)的平衡常数为0.5(mol·L-1)3 |
| C.在某条件下达到平衡,测得Ni(CO)4、CO浓度均为0.5mol/L,则此时温度高于80℃ |
| D.80℃达到平衡时,保持体积不变,往体系中充入一定量的CO,再次达到平衡后CO的体积分数减小 |
下图是可逆反应X2+3Y2 2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
| A.t1时,只有正方向反应 | B.t1~t2时,X2的物质的量越来越多 |
| C.t2~t3,反应不再发生 | D.t2~t3,各物质的浓度不再发生变化 |
 zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是