题目内容
下列图示与对应的叙述相符的是 ( )
图1 图2 图3 图4
| A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示0.1000 mol·L-1NaOH溶液滴定20.00mL0.1000 mol·L-1CH3COOH溶液所得到的滴定曲线 |
| C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的饱和溶液 |
| D.图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v正 > v逆 |
D
解析试题分析:图1表示放热反应,而不是吸热反应,因为反应物总能量高于生成物总能量,故A错误;醋酸不能完全电离,则滴定前0.1000 mol·L-1CH3COOH溶液pH大于1,而不是1,该滴定曲线的起点应向上平移2个单位左右,故B错误;80 ℃时KNO3的溶解度高于a点,说明图中a点所示的溶液是80 ℃时KNO3的不饱和溶液,而不是饱和溶液,故C错误;t时生成物的量还没有达到最大限度,说明反应向正反应方向进行,则v正 > v逆,故D正确。
考点:考查化学反应中体系能量变化示意图、酸碱中和滴定曲线、盐的溶解度曲线、物质的量-反应时间曲线,主要是辨别放热反应和吸热反应、强酸弱酸、饱和溶液与不饱和溶液、化学反应进行的方向与正逆反应速率大小的关系,以及溶液浓度与溶液pH的简单计算。

某研究小组研究了其他条件不变时,改变条件对以下可逆反应的影响:
2SO2(g)+O2(g) 2SO3(g) +Q
2SO3(g) +Q
下列说法正确的是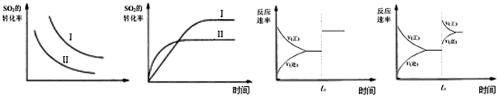
图一 图二 图三 图四
| A.图一研究的是温度、压强对平衡的影响,横坐标表示压强 |
| B.图二研究的是温度对平衡的影响,Ⅱ采用的温度更高 |
| C.图三中t0时使用了催化剂,使平衡向正反应方向进行 |
| D.图四中t0时增大压强,使平衡向正反应方向进行 |
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法错误的是
CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法错误的是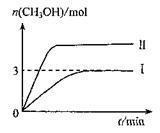
| A.曲线II对应的条件改变是增大压强 |
| B.T2°C时,上述反应平衡常数为0.42,则T2> T1 |
| C.在T10C,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),则达平衡前v(正)>v(逆) |
D.在T10C,若起始时向容器由通入4,5 molCO2、6mol H2 ,平衡时容器内压强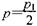 |
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)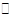 4NO2 +O2(g)△H>0,T1温度下的部分实验数据为:
4NO2 +O2(g)△H>0,T1温度下的部分实验数据为:
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol/L | 5.00 | 3.55 | 2.50 | 2.50 |
下列说法中,正确的是:
A.当反应体系内气体的平均相对分子质量不再发生变化时则该反应达到了平衡
B.T1温度下的平衡常数为K1=125,500s时N2O5的转化率为71%:
C.其他条件不变时,T2温度下反应到2000s时测得N2O5 (g)浓度为2.78mol/L, 则T1<T2
D.T1温度下的平衡常数为K1,若维持T1温度不变,增加体系压强,达到新的平衡时,平衡常数为K2,则K2>K1
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是
CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是
| A.该反应的△H<0 |
| B.其他条件不变,升高温度反应的平衡常数增大 |
C.300℃时,0–t1 min内CH3OH的平均生成速率为 mol?L-1 min-1 mol?L-1 min-1 |
D.A点的反应体系从300℃升高到500℃,达到平衡时 减小 减小 |
下列反应中产生气泡速率最快的是
| | 温度 | 浓度 | 催化剂 |
| A | 25℃ | 2mL5%H2O2 | 0.1mol/LFeCl32滴 |
| B | 35℃ | 2mL8%H2O2 | MnO2粉末 |
| C | 25℃ | 2mL5%H2O2 | MnO2粉末 |
| D | 25℃ | 2mL8%H2O2 | 0.1mol/LCuCl22滴 |
关于下列四个说法正确的是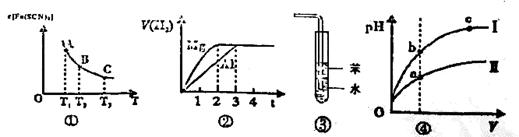
| A.已知图①是体系Fe3++3SCN-=Fe(SCN)3中c[Fe(SCN)3]与温度T的平衡图像,则A点与B点相比,A点的Fe3+浓度大 |
| B.图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V(H2) 与时间t的关系。则反应中镁和铝的反应速率之比为2 : 3 |
| C.图③可用于吸收HCl气体,并防倒吸 |
| D.图④是某温度下,相同体积,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线。II为醋酸稀释时pH的变化曲线 |
在25℃时,密闭容器中X、Y、Z三种气体的浓度变化情况如图: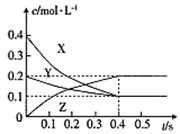
下列说法错误的是( )
A.反应可表示为3X+Y 2Z 2Z |
| B.从反应开始到0.4s时,以Y表示的化学反应速率为:0.25mol·L-1·s-1 |
| C.增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| D.升高温度,平衡常数可能增大也可能减小 |
 3C (g) 。下列叙述中表明该可逆反应一定达到平衡状态的是
3C (g) 。下列叙述中表明该可逆反应一定达到平衡状态的是