题目内容
元素M的最高正价和负价的绝对值之差为6,M、N的离子具有相同的电子排布,则M、N所形成的化合物可能是( )
| A、MgF2 |
| B、MgCl2 |
| C、CaCl2 |
| D、CaBr2 |
考点:原子结构与元素的性质
专题:原子组成与结构专题
分析:元素M的最高正价和负价的绝对值之差为6,其最高正价和最低负化合价的绝对值之和为8,则其最高正价为+7价、最低负价为-1价,M、N的离子具有相同的电子排布,则N位于M的下一周期,且最外层电子数小于4,据此分析解答.
解答:
解:元素M的最高正价和负价的绝对值之差为6,其最高正价和最低负化合价的绝对值之和为8,则其最高正价为+7价、最低负价为-1价,位于第VIIA族(F元素除外),M、N的离子具有相同的电子排布,则N位于M的下一周期,且最外层电子数小于4,
A.F元素没有正化合价,不符合题意,故A错误;
B.如果M是Cl元素,则N位于第四周期元素,Mg位于第二周期,不符合题意,故B错误;
C.如果M是Cl元素,则N位于第四周期元素,Ca位于第四周期,符合题意,故C正确;
D.如果M是Br元素,则N位于第五周期元素,Ca位于第四周期,不符合题意,故D错误;
故选C.
A.F元素没有正化合价,不符合题意,故A错误;
B.如果M是Cl元素,则N位于第四周期元素,Mg位于第二周期,不符合题意,故B错误;
C.如果M是Cl元素,则N位于第四周期元素,Ca位于第四周期,符合题意,故C正确;
D.如果M是Br元素,则N位于第五周期元素,Ca位于第四周期,不符合题意,故D错误;
故选C.
点评:本题考查了原子结构和元素性质,根据元素化合价确定M元素所属主族,再根据M、N离子结构关系确定N的位置,注意F元素没有正化合价,为易错点.

练习册系列答案
相关题目
绿色化学的核心内涵是在反应过程中和化工生产中,尽量减少或彻底消除使用和产生有害物质,下列说法不正确的是( )
| A、大量使用天然气作燃料对环境无任何污染 |
| B、制硫酸工厂的尾气常用碱液吸收 |
| C、氢气是一种无污染能源 |
| D、为消除制硫酸尾气中二氧化硫的污染,可杂燃烧炉中加入石灰石固硫 |
某地有甲、乙两工厂排放污水,污水中各含有下列8种离子中的4种(两厂不含相同的离子):Ag+、Ba2+、Fe3+、Na+、SO42-、NO3-、OH-、Cl-.两厂单独排放都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便变成无色澄清的只含硝酸钠而排放,污染程度大大降低.关于污染源的分析,你认为正确的是( )
| A、SO42-和NO3- 可能来自同一工厂 |
| B、Cl-和NO3- 一定在不同的工厂 |
| C、Ag+和Na+可能来自同一工厂 |
| D、Na+和NO3- 一定不来自同一工厂 |
如图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数.
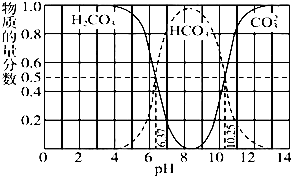
下列叙述正确的是( )

下列叙述正确的是( )
| A、此图是1.0mol?L-1碳酸钠溶液滴定1.0 mol?L-1?HCl溶液的滴定曲线 |
| B、在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-) |
| C、人体血液的pH约为7.4,则CO2在血液中多以HCO-3形式存在 |
| D、若用CO2和NaOH反应制取NaHCO3,应控制溶液的pH偏大或偏小 |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、0.1mol Fe在过量的Cl2中充分燃烧,转移的电子数为0.3NA |
| B、常温下,22.4L甲烷中含有的共价键数目为4NA |
| C、2mol SO2和1mol O2在密闭容器中催化加热,充分反应后,容器内分子总数为2NA |
| D、由CO2和O2组成的混合气体中共有NA个分子,其中的氧原子数为2NA |
下列说法正确的是( )
| A、NaHSO3和NaHCO3的混合溶液中(S和C均用R表示):c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-) |
| B、常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2,三种溶液中水的电离程度:③>①>② |
| C、39g Na2O2与足量水反应后转移的电子数为NA(NA表示阿伏加德罗常数的值) |
| D、当6.9g Fe3O4与足量稀HNO3反应(还原产物只有NO),则参加反应的HNO3为0.28mol |
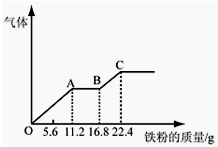 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A、原混合酸中NO3-物质的量浓度为2mol/L |
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 |
| C、第二份溶液中最终溶质为FeSO4 |
| D、H2SO4浓度为2.5mol?L-1 |
