题目内容
如图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数.
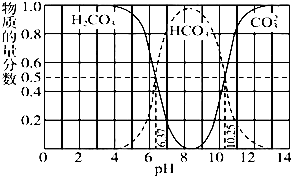
下列叙述正确的是( )

下列叙述正确的是( )
| A、此图是1.0mol?L-1碳酸钠溶液滴定1.0 mol?L-1?HCl溶液的滴定曲线 |
| B、在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-) |
| C、人体血液的pH约为7.4,则CO2在血液中多以HCO-3形式存在 |
| D、若用CO2和NaOH反应制取NaHCO3,应控制溶液的pH偏大或偏小 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.1.0mol/L碳酸钠溶液滴定1.0mol/LHCl溶液,在碳酸浓度达到饱和之前,浓度应逐渐增大,且起始浓度不可能为1.0mol/L;
B.由图可知,pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-),物质的量分数相等,但是溶液的体积不相等;
C.由图可知,pH为7.4时,HCO3-的浓度远远大于碳酸的浓度;
D.根据图可知,pH在7~9之间时,溶液中主要以碳酸氢根离子形式存在.
B.由图可知,pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-),物质的量分数相等,但是溶液的体积不相等;
C.由图可知,pH为7.4时,HCO3-的浓度远远大于碳酸的浓度;
D.根据图可知,pH在7~9之间时,溶液中主要以碳酸氢根离子形式存在.
解答:
解:A.1.0mol/L碳酸钠溶液滴定1.0mol/LHCl溶液,在碳酸浓度达到饱和之前,碳酸浓度应逐渐增大,且起始浓度不可能为1.0mol/L,故A错误;
B.由图可知,pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-),由于溶液的体积不相等,所以三者的浓度不相等,故B错误;
C.由图可知,pH为7.4时,HCO3-的物质的量远远大于碳酸的,则当人体血液的pH约为7.4,CO2在血液中多以HCO3-的形式存在,故C正确;
D.由图可知,溶液的pH为7~9之间时,溶液中的阴离子主要以HCO3-形式存在,溶液中的溶质主要为碳酸氢钠,所以若用CO2和NaOH反应制取NaHCO3,溶液的pH应该控制在7~9之间,故D错误;
故选C.
B.由图可知,pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-),由于溶液的体积不相等,所以三者的浓度不相等,故B错误;
C.由图可知,pH为7.4时,HCO3-的物质的量远远大于碳酸的,则当人体血液的pH约为7.4,CO2在血液中多以HCO3-的形式存在,故C正确;
D.由图可知,溶液的pH为7~9之间时,溶液中的阴离子主要以HCO3-形式存在,溶液中的溶质主要为碳酸氢钠,所以若用CO2和NaOH反应制取NaHCO3,溶液的pH应该控制在7~9之间,故D错误;
故选C.
点评:本题考查学生的识图和应用能力,题目难度中等,正确分析图象中pH与离子的浓度关系是解答本题的关键,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
下列关于有机物的说法中不正确的是( )
| A、乙醇和乙酸均可以使酸性高锰酸钾溶液褪色 |
| B、淀粉、油脂、蛋白质在一定条件下都能发生水解反应 |
| C、正丁烷比异丁烷的沸点高 |
| D、乙醇和乙酸均能与金属钠能反应 |
下列各组物质中,可用分液漏斗分离的一组是( )
| A、酒精和水 | B、苯和水 |
| C、乙酸和乙酸乙酯 | D、碘酒和水 |
推理是研究和学习化学的一种重要方法.以下推理正确的是( )
| A、酸碱发生中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 |
| B、碱中都含有氢氧根,所以碱中一定含有氢元素 |
| C、酸能使紫色石蕊溶液变红,CO2通入紫色石蕊溶液后溶液变红,所以CO2是酸 |
| D、有机物都含碳元素,所以含碳元素的化合物都是有机物 |
下列反应中,不属于氧化还原反应的是( )
| A、3Cl2+6KOH═5KCl+KClO3+3H2O |
| B、2FeBr2+3Cl2═2FeCl3+2Br2 |
| C、SnCl4+2H2O═SnO2+4HCl |
| D、Ca(OH )2+CO2═CaCO3↓+H2O |
元素M的最高正价和负价的绝对值之差为6,M、N的离子具有相同的电子排布,则M、N所形成的化合物可能是( )
| A、MgF2 |
| B、MgCl2 |
| C、CaCl2 |
| D、CaBr2 |
已知两种物质发生化学反应的微观示意图如图(一种小球代表一种原子,原子间的短线代表原子的结合),下列说法正确的是( )
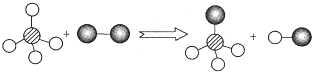

| A、图示中共有3种分子 |
| B、说明化学反应中原子不可分 |
| C、该图示不符合质量守恒定律 |
| D、该反应属于置换反应 |
 如图是常见固体物质的溶解度曲线,根据图示回答:
如图是常见固体物质的溶解度曲线,根据图示回答: