题目内容
某地有甲、乙两工厂排放污水,污水中各含有下列8种离子中的4种(两厂不含相同的离子):Ag+、Ba2+、Fe3+、Na+、SO42-、NO3-、OH-、Cl-.两厂单独排放都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便变成无色澄清的只含硝酸钠而排放,污染程度大大降低.关于污染源的分析,你认为正确的是( )
| A、SO42-和NO3- 可能来自同一工厂 |
| B、Cl-和NO3- 一定在不同的工厂 |
| C、Ag+和Na+可能来自同一工厂 |
| D、Na+和NO3- 一定不来自同一工厂 |
考点:常见离子的检验方法
专题:离子反应专题
分析:将两厂的污水按一定比例混合,沉淀后污水便能变得无色澄清,说明甲乙两厂的废水能反应生成沉淀,从离子能否大量共存的角度分析,可假设甲厂含有Ag+,则一定不含SO42-、OH-、Cl-,则SO42-、OH-、Cl-应存在与乙厂,因Ba2+与SO42-、Fe3+与OH-不能共存,则Fe3+、Ba2+存在于甲厂,根据溶液呈电中性可知,甲厂一定存在NO3-;所以甲厂含有的离子有:Ag+、Ba2+、Fe3+、NO3-,乙厂含有的离子为:Na+、Cl-、SO42-、OH-,以此解答该题.
解答:
解:假设甲厂排放的污水中含有Ag+,根据离子共存,甲厂一定不含SO42-、OH-、Cl-,则SO42-、OH-、Cl-应存在与乙厂;
因Ba2+与SO42-、Fe3+与OH-不能共存,则Fe3+、Ba2+存在于甲厂,根据溶液呈电中性可知,甲厂一定存在阴离子NO3-;
所以甲厂含有的离子有:Ag+、Ba2+、Fe3+、NO3-,乙厂含有的离子为:Na+、Cl-、SO42-、OH-,
A.根据以上分析可知,SO42-离子和NO3-不可能来自同一工厂,故A错误;
B.根据分析可知,Cl-和NO3-一定来自不同工厂,故B正确;
C.Ag+和Na+一定来自不同工厂,故C错误;
D.由分析可知,Na+和NO3-一定来自不同的工厂,故D正确;
故选BD.
因Ba2+与SO42-、Fe3+与OH-不能共存,则Fe3+、Ba2+存在于甲厂,根据溶液呈电中性可知,甲厂一定存在阴离子NO3-;
所以甲厂含有的离子有:Ag+、Ba2+、Fe3+、NO3-,乙厂含有的离子为:Na+、Cl-、SO42-、OH-,
A.根据以上分析可知,SO42-离子和NO3-不可能来自同一工厂,故A错误;
B.根据分析可知,Cl-和NO3-一定来自不同工厂,故B正确;
C.Ag+和Na+一定来自不同工厂,故C错误;
D.由分析可知,Na+和NO3-一定来自不同的工厂,故D正确;
故选BD.
点评:本题考查离子共存的判断,题目难度中等,注意掌握离子反应发生条件,能够根据离子反应条件判断离子是否能够共存,正确理解题干信息为解答本题的关键.

练习册系列答案
相关题目
现有X、Y、Z、W、Q五种短周期元素,原子序数依次增大,Y、Z、W、Q形成的简单离子具有相同的电子层结构,YX3、X2Z、X2Z2、W2Z、W2Z2都是常见的化合物,其中,YX3在常温下呈气态,能使酚酞溶液变红色.下列有关推断正确的是( )
| A、简单离子半径:Y>Z>W>Q>X |
| B、W2Z2与X2Z反应中氧化剂与还原剂物质的量之比为1:2 |
| C、X能分别与Y、Z、W形成共价化合物 |
| D、Y、W、Q的最高价氧化物对应的水化物两两之间一定相互反应 |
下列叙述正确的是(设NA为阿伏加德罗常数的数值)( )
| A、检验溶液中是否含有Fe2+的方法是先滴加氯水,再滴加KSCN溶液 |
| B、铅蓄电池放电时的负极反应式为:Pb02+4H2SO4+2e-═PbSO4+2H2O |
| C、Na2CO3溶液加水稀释后,恢复至原温度,溶液的pH和Kw均减小 |
| D、某电池的总反应为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,每生成1mol Na2Mn5O10转移电子数2NA |
下列各组物质中,可用分液漏斗分离的一组是( )
| A、酒精和水 | B、苯和水 |
| C、乙酸和乙酸乙酯 | D、碘酒和水 |
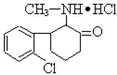 “K”粉医学上称氯胺酮,属于静脉全麻药品,具有一定的精神依赖性.因其物理形状通常为白色粉末,故称“K”粉.目前,该药物已被我国药检部门列为第二类精 神药品管理.其结构简式如下.
“K”粉医学上称氯胺酮,属于静脉全麻药品,具有一定的精神依赖性.因其物理形状通常为白色粉末,故称“K”粉.目前,该药物已被我国药检部门列为第二类精 神药品管理.其结构简式如下.下列说法正确的是( )
| A、“K”粉的化学式为C13H10NOCl2 |
| B、1mol“K”粉在一定条件下可与4mol H2发生加成反应 |
| C、“K”粉分子中至少有7个C原子处于同一平面 |
| D、“K”粉不能与NaOH溶液发生反应 |
推理是研究和学习化学的一种重要方法.以下推理正确的是( )
| A、酸碱发生中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 |
| B、碱中都含有氢氧根,所以碱中一定含有氢元素 |
| C、酸能使紫色石蕊溶液变红,CO2通入紫色石蕊溶液后溶液变红,所以CO2是酸 |
| D、有机物都含碳元素,所以含碳元素的化合物都是有机物 |
元素M的最高正价和负价的绝对值之差为6,M、N的离子具有相同的电子排布,则M、N所形成的化合物可能是( )
| A、MgF2 |
| B、MgCl2 |
| C、CaCl2 |
| D、CaBr2 |
下列说法正确的是( )
| A、淀粉、蔗糖油脂的水解产物都是葡萄糖 |
| B、可以用盐析和变性来分离提纯蛋白质 |
| C、F、Cl、Br、I的氢化物的稳定性随核电荷数的增大而减弱 |
| D、酸性氧化物在常温下均为气态 |