题目内容
下列说法正确的是( )
| A、NaHSO3和NaHCO3的混合溶液中(S和C均用R表示):c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-) |
| B、常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2,三种溶液中水的电离程度:③>①>② |
| C、39g Na2O2与足量水反应后转移的电子数为NA(NA表示阿伏加德罗常数的值) |
| D、当6.9g Fe3O4与足量稀HNO3反应(还原产物只有NO),则参加反应的HNO3为0.28mol |
考点:离子浓度大小的比较,盐类水解的应用,钠的重要化合物,铁的氧化物和氢氧化物
专题:基本概念与基本理论,元素及其化合物
分析:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.水解程度越大,水的电离程度越大;
C.n(Na2O2)=
=0.5mol,2Na2O2+2H2O=4NaOH+O2↑,根据过氧化钠和转移电子之间的关系式计算;
D.n( Fe3O4)=
=0.03mol,根据3Fe3O4+28HNO3=9Fe(NO3)3+NO↑+14H2O计算参加反应的硝酸的物质的量.
B.水解程度越大,水的电离程度越大;
C.n(Na2O2)=
| 39g |
| 78g/mol |
D.n( Fe3O4)=
| 6.9g |
| 232g/mol |
解答:
解:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-),故A错误;
B.水解程度越大,水的电离程度越大,铵根离子和碳酸根离子相互促进水解、亚铁离子抑制水解,所以三种溶液中水的电离程度:①>②>③,故B错误;
C.n(Na2O2)=
=0.5mol,2Na2O2+2H2O=4NaOH+O2↑,根据过氧化钠和转移电子之间的关系式得转移电子数=
×2×NA/mol=0.5NA,故C错误;
D.n( Fe3O4)=
=0.03mol,根据3Fe3O4+28HNO3=9Fe(NO3)3+NO↑+14H2O得参加反应的硝酸的物质的量=
×28=0.28mol,故D正确;
故选D.
B.水解程度越大,水的电离程度越大,铵根离子和碳酸根离子相互促进水解、亚铁离子抑制水解,所以三种溶液中水的电离程度:①>②>③,故B错误;
C.n(Na2O2)=
| 39g |
| 78g/mol |
| 0.5mol |
| 2 |
D.n( Fe3O4)=
| 6.9g |
| 232g/mol |
| 0.03mol |
| 3 |
故选D.
点评:本题考查了盐类水解、氧化还原反应等知识点,根据盐的性质结合守恒思想分析AB,根据氧化还原反应中各个物理量之间的关系式进行计算CD,注意D中四氧化三铁中铁元素化合价、方程式的书写,为易错点.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
下列各组物质中,可用分液漏斗分离的一组是( )
| A、酒精和水 | B、苯和水 |
| C、乙酸和乙酸乙酯 | D、碘酒和水 |
元素M的最高正价和负价的绝对值之差为6,M、N的离子具有相同的电子排布,则M、N所形成的化合物可能是( )
| A、MgF2 |
| B、MgCl2 |
| C、CaCl2 |
| D、CaBr2 |
苯与乙烯相比较,下列叙述不正确的是( )
| A、都容易发生取代反应 |
| B、苯不能被KMnO4氧化 |
| C、苯只能在特殊条件下发生加成反应 |
| D、都能在空气中燃烧 |
准确量取21.00mL KMnO4溶液,可选用的仪器是( )
| A、25mL量筒 |
| B、25mL酸式滴定管 |
| C、25mL碱式滴定管 |
| D、有刻度的50mL烧杯 |
下列说法正确的是( )
| A、淀粉、蔗糖油脂的水解产物都是葡萄糖 |
| B、可以用盐析和变性来分离提纯蛋白质 |
| C、F、Cl、Br、I的氢化物的稳定性随核电荷数的增大而减弱 |
| D、酸性氧化物在常温下均为气态 |
已知两种物质发生化学反应的微观示意图如图(一种小球代表一种原子,原子间的短线代表原子的结合),下列说法正确的是( )
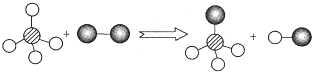

| A、图示中共有3种分子 |
| B、说明化学反应中原子不可分 |
| C、该图示不符合质量守恒定律 |
| D、该反应属于置换反应 |
 如图是常见固体物质的溶解度曲线,根据图示回答:
如图是常见固体物质的溶解度曲线,根据图示回答:
 可写成
可写成