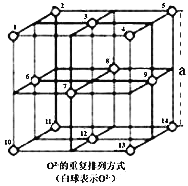
题目内容
【题目】下列离子反应方程式正确的是
A.向NaAlO2溶液中通入过量CO2制Al(OH)3:2![]() +CO2+3H2O=2Al(OH)3↓+
+CO2+3H2O=2Al(OH)3↓+![]()
B.用硫酸酸化的淀粉碘化钾溶液在空气中变蓝:4I-+O2+4H+=2I2+2H2O
C.漂白粉溶液通入少量SO2:Ca2++2ClO-+SO2+H2O=2HClO+CaSO3↓
D.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑
【答案】B
【解析】
A.向NaAlO2溶液中通入过量CO2制Al(OH)3,由于二氧化碳过量,生成氢氧化铝沉淀和碳酸氢钠,离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故A错误;
B.用硫酸酸化的淀粉碘化钾溶液在空气中变蓝,碘离子具有还原性,被空气中的氧气氧化为单质碘,碘单质遇淀粉变蓝,反应的离子方程式为4I-+O2+4H+═2H2O+2I2,故B正确;
C.漂白粉溶液通入少量SO2,由于次氯酸根离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子,其离子方程式为:SO2+Ca2++3ClO-+H2O=CaSO4↓+2HClO+Cl-,故C错误;
D.Na2O2与水反应生成氢氧化钠和O2,正确的离子方程式为:2Na2O2+2H2O═4Na++4OH-+O2↑,题目中离子方程式氧原子个数不等,故D错误;
答案B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:① 2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)
NaNO3(s)+ClNO(g) K1;②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g) K2;③2NO(g)+Cl2(g)![]() 2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________(用K1和K2表示);
2ClNO(g) K3,则K1、K2、K3之间的关系为K3=_______________(用K1和K2表示);
(2)已知几种化学键的键能数据如下表:(亚硝酰氯的结构为Cl—N==O)
化学键 | N≡O | Cl-Cl | Cl-N | N==O |
键能/(kJ·mol-1) | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g)![]() 2ClNO(g)的反应的 △H和a的关系为 △H = ___kJ·mol-1。
2ClNO(g)的反应的 △H和a的关系为 △H = ___kJ·mol-1。
(3)300℃时,2NO(g)+Cl2 (g)![]() 2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为v正 = k·cn (ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/(mol·L-1) | v/(mol·L-1·s-l) |
① | 0. 30 | 3. 60×10-9 |
② | 0. 60 | 1. 44×10-8 |
③ | 0. 90 | 3. 24×10-8 |
n = ___;k = ____。
(4)若向绝热恒容密闭容器中充入物质的量之比为2 : 1的NO和Cl2进行反应2NO(g)+Cl2(g)![]() 2ClNO(g),能判断反应已达到化学平衡状态的是__(填标号)。
2ClNO(g),能判断反应已达到化学平衡状态的是__(填标号)。
a.容器中的压强不变 b.2v正(NO) = v逆(Cl2)c.气体的平均相对分子质量保持不变 d.该反应平衡常数保持不变e.NO和Cl2的体积比保持不变
(5)25℃时,向体积为2 L且带气压计的恒容密闭容器中通入0.08 mol NO和0.04 mol Cl2发生反应:2NO(g)+Cl2 (g)![]() 2ClNO(g)△H。
2ClNO(g)△H。
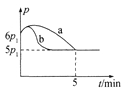
①若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图甲曲线a所示,则 △H __(填“>”“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图甲曲线b所示,则改变的条件是______。
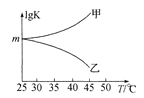
②图是甲、乙同学描绘上述反应平衡常数的对数值(lg K)与温度的变化关系,其中正确的曲线是____(填“甲”或“乙”),m值为_____。