题目内容
6.某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl.下列说法正确的是( )
| A. | 正极反应为Ag-e-=Ag+ | |
| B. | 放电时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 当电路中转移0.1mol e-,通过交换膜的阳离子为0.2mol | |
| D. | 用KCl溶液代替盐酸,则电池总反应不改变 |
分析 根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
A、正极上氯气得电子;
B、阳离子交换膜只能阳离子通过;
C、放电时,当电路中转移0.1mol e-时,交换膜左则会有0.1mol氢离子通过阳离子交换膜向正极移动;
D、根据电池总反应判断.
解答 解:根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
A、正极上氯气得电子生成氯离子,其电极反应为:Cl2+2e-═2Cl-,故A错误;
B、放电时,左侧Ag溶解生成银离子,银离子和氯离子反应生成AgCl沉淀,所以左侧生成白色沉淀,左侧氢离子通过离子交换膜进入右侧,故B错误;
C、放电时,当电路中转移0.1mol e-时,交换膜左则会有0.1mol氢离子通过阳离子交换膜向正极移动,故C错误;
D、根据电池总反应为2Ag+Cl2═2AgCl可知,用KCl溶液代替盐酸,电池的总反应不变,故D正确;
故选D.
点评 本题考查了原电池原理的应用及沉淀反应,注意把握原电池原理及正负极的判断和电极方程式的书写,利用电子及电荷守恒来解决原电池中有关计算的问题,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列各组顺序的排列不正确的是( )
| A. | 熔点:金刚石>食盐>干冰 | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 沸点:HF>HBr>HCl | D. | 离子半径:Na+<Mg2+<Al3+ |
17.下列指定微粒的个数比等于2:1的是( )
| A. | ${\;}_{1}^{2}$H原子的中子数和质子数 | |
| B. | ${\;}_{18}^{36}$Ar原子中的质量数和中子数 | |
| C. | ${\;}_{4}^{8}$Be2+离子中的电子数和质子数 | |
| D. | ${\;}_{12}^{26}$Mg2+离子中的中子数和电子数 |
1.下列反应不属于取代反应的是( )
| A. | 溴乙烷与氢氧化钠水溶液共热 | |
| B. | 溴乙烷与氧氧化钠的乙醇溶液共热 | |
| C. | 甲烷与氯气反应 | |
| D. | 乙炔与氯化氢在一定条件下制氯乙烯 |
11.Al(OH)3即能与酸起反应,又能与强碱溶液起反应生成盐和水,说明Al(OH)3属于( )
| A. | 两性氧化物 | B. | 两性氢氧化物 | C. | 盐 | D. | 有机物 |
18.还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
2CrO${\;}_{4}^{2-}$$\underset{\stackrel{{H}^{+}}{→}}{转换}$Cr2O${\;}_{7}^{2-}$$\underset{\stackrel{F{e}^{2+}}{→}}{还原}$Cr3+$\underset{\stackrel{O{H}^{-}}{→}}{沉淀}$Cr(OH)3↓
已知转化过程中的反应为2CrO${\;}_{4}^{2-}$(aq)+2H+(aq)?Cr2O${\;}_{7}^{2-}$(aq)+H2O(l)
,转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有$\frac{10}{11}$转化为Cr2072-,下列说法不正确的是( )
2CrO${\;}_{4}^{2-}$$\underset{\stackrel{{H}^{+}}{→}}{转换}$Cr2O${\;}_{7}^{2-}$$\underset{\stackrel{F{e}^{2+}}{→}}{还原}$Cr3+$\underset{\stackrel{O{H}^{-}}{→}}{沉淀}$Cr(OH)3↓
已知转化过程中的反应为2CrO${\;}_{4}^{2-}$(aq)+2H+(aq)?Cr2O${\;}_{7}^{2-}$(aq)+H2O(l)
,转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有$\frac{10}{11}$转化为Cr2072-,下列说法不正确的是( )
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeS04•7H2O)作还原剂,处理1 L废水,至少需要458.7g | |
| C. | 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5 | |
| D. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
16.生活处处有化学,下列说法正确的是( )
| A. | “加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是对应的单质分子,而钙、铁则指的是对应的钙离子和铁离子 | |
| B. | 淀粉及做衣服的棉和麻均为天然高分子化合物 | |
| C. | 煎炸食物的花生油和牛油都是可水解的饱和酯类 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |

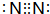 ,E的化学式为NO.
,E的化学式为NO. .
. .
.