题目内容
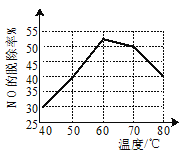
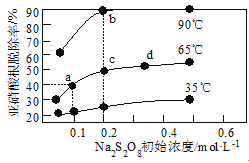
【题目】1molH2(g)与1molI2(g)反应生成HI(g)释放出8.7kJ热量,有关数据如图所示:
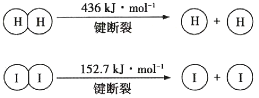
下列说法不正确的是( )
A.H2和I2的总能量低于HI的能量
B.破坏1molH—I键需要的能量是298.7kJ
C.1molHI(g)完全分解生成H2(g)和I2(g)时吸收4.35kJ热量
D.H2(g)中的H—H键比HI(g)中的H—I键牢固
【答案】A
【解析】
A. H2和I2反应的化学方程式为I2(g)+H2(g)![]() 2HI(g),该反应为放热反应,所以1molH2(g)和1molI2(g)的总能量高于2molHI(g)的能量,A项错误;
2HI(g),该反应为放热反应,所以1molH2(g)和1molI2(g)的总能量高于2molHI(g)的能量,A项错误;
B. 设破坏1molH-I键需要的能量为xkJ,则有2x kJ-436kJ-152.7kJ=8.7kJ,解得x=298.7,B项正确;
C. 生成2molHI(g)释放出8.7kJ热量,则1molHI(g)完全分解生成H2(g)和I2(g)时吸收的热量![]() =4.35kJ,C项正确;
=4.35kJ,C项正确;
D. 破坏1molH—H键需要能量436kJ,根据B项计算破坏1molH—I键需要能量298.7 kJ,所以H2(g)中的H一H键比HI(g)中的H—I键牢固,D项正确;
答案选A。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】现有某些短周期元素的性质或原子结构信息如表所示。
元素 | 元素性质或原子结构信息 |
T | M层上有6个电子 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下的单质为双原子分子,其简单氢化物的水溶液呈碱性 |
Z | 元素的最高正价是+7 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是______。
(2)元素Y与氢元素能形成两种常见的10电子微粒,且在一定条件下,其中一种微粒与OH反应可以转化为另一种微粒,该反应的离子方程式为_________________。
(3)元素Z与元素T相比,非金属性较强的是______(填元素符号),下列表述能证明这一事实的是_______(填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的简单氢化物比T的简单氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是____(填对应酸的化学式),理由是__________。