题目内容
15.常温下将amL0.1mol/L CH3COOH溶液和bmL0.1mol/L KOH溶液充分混合,下列判断一定错误的是( )| A. | 若a<b,c(K+)+c(H+)=c(CH3COO-)+c(OH-) | B. | 若a=b,c(K+)>c(CH3COO-)>c(H+)>c(OH-) | ||
| C. | 若a=b,c(K+)=c(CH3COO-)+c(CH3COOH) | D. | 若a>b,c(CH3COO-)>c(H+)>c(K+)>c(OH-) |
分析 A.若a<b,KOH过量,则混合后溶质为CH3COOK和KOH,根据电荷守恒分析;
B.若a=b,二者恰好反应,则混合后溶质为CH3COOK,溶液显碱性;
C.若a=b,二者恰好反应,则混合后溶质为CH3COOK,根据物料守恒分析;
D.若a>b,CH3COOH过量,则混合后溶质为CH3COOH和CH3COOK,若醋酸的剩余较多,而生成的CH3COOK很少,溶液显酸性.
解答 解:A.若a<b,KOH过量,则混合后溶质为CH3COOK和KOH,溶液中电荷守恒为c(K+)+c(H+)=c(CH3COO-)+c(OH-),故A正确;
B.若a=b,二者恰好反应,则混合后溶质为CH3COOK,醋酸根离子水解溶液显碱性,则c(K+)>c(CH3COO-)>c(OH-)>c(H+),故B错误;
C.若a=b,二者恰好反应,则混合后溶质为CH3COOK,醋酸根离子部分水解生成CH3COOH,由物料守恒可知c(K+)=c(CH3COO-)+c(CH3COOH),故C正确;
D.若a>b,CH3COOH过量,则混合后溶质为CH3COOH和CH3COOK,若醋酸的剩余较多,而生成的CH3COOK很少,溶液显酸性,则c(CH3COO-)>c(H+)>c(K+)>c(OH-),故D正确.
故选B.
点评 本题考查了酸碱混合溶液中离子浓度大小比较,题目难度中等,注意把握电荷守恒和物料守恒的应用,侧重于考查学生的分析能力.

练习册系列答案
相关题目
4.在一密闭容器中,反应aA(g)═bB(g)达平衡(I).保持温度不变,将容器体积增加一倍,当达到新的平衡(II),实验测得cB(II):cB(I)B=2:5,则下列说法正确的是( )
| A. | 平衡向正反应方向移动 | B. | 物质A的转化率降低 | ||
| C. | 物质B的质量分数增加 | D. | a<b |
6.下列根据实验操作、实验现象所得出的结论不正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| B | 其他条件不变,压缩2HI(g)?I2(g)+H2(g)平衡体系的体积 | 混合气体颜色变深 | 平衡向生成I2(g)的方向移动 |
| C | 将碱式滴定管下部的胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠 | 使溶液从尖嘴流出 | 排出碱式滴定管尖嘴部分的气泡 |
| D | 向2.0mL浓度均为0.1mol•L-1的KCl、KI混合溶液中滴加1-2滴0.01mol•L-1AgNO3溶液,振荡 | 沉淀呈黄色 | KSP(AgCl)>KSP(AgI) |
| A. | A | B. | B | C. | C | D. | D |
20.下列离子方程式书写正确的是( )
| A. | 过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | Fe2O3溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-═H2O+NH3↑ | |
| D. | 二氧化硫通入溴水中,溴水褪色:SO2+Br2+2H2O═4H++2Br-+SO42- |
4.化学无处不在,下列与化学有关的说法不正确的是( )
| A. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| B. | 可用蘸浓硫酸的棉棒检验输送氨气的管道是否漏气 | |
| C. | 碘是人体必需微量元素,所以要适量吃富含碘酸根原子团的食物 | |
| D. | 黑火药由硫黄、硝石、木炭三种物质按一定比例混合制成 |
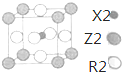 X、Y、Z、W、R是原子序数依次增大的前四周期元素(稀有气体除外).X的基态原子中的电子平均分布在三个不同的能级中;Y的族序数是其周期数的三倍;Z的基态原子核外无未成对电子;W为前四周期中电负性最小的元素;元素R位于周期表的第10列.
X、Y、Z、W、R是原子序数依次增大的前四周期元素(稀有气体除外).X的基态原子中的电子平均分布在三个不同的能级中;Y的族序数是其周期数的三倍;Z的基态原子核外无未成对电子;W为前四周期中电负性最小的元素;元素R位于周期表的第10列. .
.
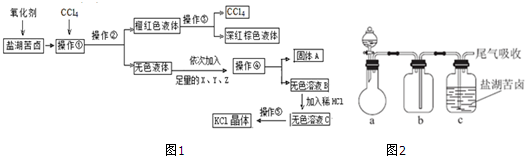
 .
.

 C
C ;
; ;该反应类型为消去反应.
;该反应类型为消去反应.