题目内容
13.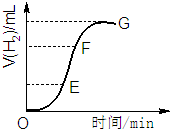 用不纯的锌粒与2mol/L盐酸反应制取氢气气体,请回答:
用不纯的锌粒与2mol/L盐酸反应制取氢气气体,请回答:(1)实验过程如图所示,分析判断EF段化学反应速率最快,这段反应速率最快的原因是反应是放热反应,随着溶液的进行,溶液温度升高,溶液浓度虽然较小,但温度影响大于浓度影响,所以反应速率快.
(2)为了加快上述反应的速率,欲向溶液中加入下列物质,你认为可行的是CD
A.蒸馏水 B.纯净锌粒 C.CuSO4溶液 D.6mol/L盐酸
(3)除了上述方法外,你认为还可以采取哪些措施来加快该化学反应速率?(回答一种即可)升高温度.
分析 (1)反应速率=$\frac{△c}{△t}$,所以曲线的斜率越大,其反应速率越快;溶液浓度、温度都增大反应速率;
(2)增加反应物浓度、增大固体表面积、以及形成原电池等都能加快反应速率;
(3)可以采用升高温度的方法加快反应速率.
解答 解:(1)反应速率=$\frac{△c}{△t}$,所以曲线的斜率越大,其反应速率越快,所以反应速率最快的是EF段;生成氢气体积等于该曲线纵坐标之差,所以生成氢气体积最大的是EF段;溶液浓度、温度都增大反应速率,因为该反应是放热反应,随着溶液的进行,溶液温度升高,溶液浓度虽然较小,但温度影响大于浓度影响,所以反应速率快,
故答案为:EF;该反应是放热反应,随着溶液的进行,溶液温度升高,溶液浓度虽然较小,但温度影响大于浓度影响,所以反应速率快;
(2)减小反应物浓度能减缓反应速率,
A.加入蒸馏水,降低酸浓度,所以反应速率减缓,故错误;
B.因为锌为固体,则加入锌粒,反应速率不变,故错误;
C.加入CuSO4溶液,锌将铜置换出来与锌形成原电池,所以反应速率加快,故正确;
D.加入6mol/L盐酸,酸浓度增大,反应速率加快,故正确;
故选CD;
(3)还可以采用升高温度的方法加快反应速率,故答案为:升高温度.
点评 本题考查化学反应速率影响因素,为高频考点,温度、浓度、催化剂、反应物接触面积等都影响反应速率,难点是(1)题图象分析,知道曲线斜率的含义.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
16.下列有关化学与自然资源的开发利用说法中不正确的是( )
| A. | 海水提溴是将海水中的化合态的溴富集再转化为游离态的溴 | |
| B. | 石油裂化的主要目的是提高汽油的产量 | |
| C. | 煤干馏的产品很多,是一个化学变化 | |
| D. | 海水提镁的过程为:MgCl2(aq)$\stackrel{石灰乳}{→}$ Mg(OH)2$\stackrel{煅烧}{→}$MgO$\stackrel{电解}{→}$Mg |
4.下列各组元素均属于p区元素的是( )
| A. | H、He、N | B. | O、S、P | C. | Fe、Ar、Cl | D. | Na、Li、Mg |
1.X、Y为两种元素的原子,X的阴离子与Y的阳离子具有相同的电子层结构,下列判断错误的是( )
| A. | X的电负性大于Y的电负性 | B. | X的原子半径大于Y的原子半径 | ||
| C. | X的氧化性大于Y的氧化性 | D. | X的第一电离能大于Y的第二电离能 |
5.下表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.
(1)上述元素的单质可能是电的良导体的是acfhg(填字母代号).
(2)下表是一些气态基态原子的第一、二、三、四级电离能(kJ•mol-1):
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量Li原子失去1个电子后形成稳定结构,再失去1个电子很困难
②表中Y可能为以上13种元素中的f(填写字母)元素.用元素符号表示X和j形成化合物的电子式 .
.
(3)根据构造原理,用电子排布式表示e的特征电子构型1s22s22p63s23p63d24s2
(4)以上13种元素中m(填写字母)元素原子失去核外第一个电子需要的能量最多.
| b | |||||||||||||||||
| h | j | ||||||||||||||||
| a | c | f | i | l | m | ||||||||||||
| e | g | ||||||||||||||||
| d | k | ||||||||||||||||
(2)下表是一些气态基态原子的第一、二、三、四级电离能(kJ•mol-1):
| 锂 | X | Y | |
| 第一电离能 | 519 | 502 | 580 |
| 第二电离能 | 7296 | 4570 | 1820 |
| 第三电离能 | 11799 | 6920 | 2750 |
| 第四电离能 | 9550 | 11600 |
②表中Y可能为以上13种元素中的f(填写字母)元素.用元素符号表示X和j形成化合物的电子式
 .
.(3)根据构造原理,用电子排布式表示e的特征电子构型1s22s22p63s23p63d24s2
(4)以上13种元素中m(填写字母)元素原子失去核外第一个电子需要的能量最多.
3.体积相同pH相等的a杯盐酸和b杯醋酸溶液分别与相同质量的锌反应,若最后锌都完全溶解,则下列判断正确的是( )
| A. | 反应所生成的气体体积:a杯>b杯 | B. | 反应所需要的时间:a杯>b杯 | ||
| C. | 刚开始时反应的速率:b杯>a杯 | D. | 整个反应阶段平均速率:a杯>b杯 |
 、C:CH3CH2OH D:CH3COOH
、C:CH3CH2OH D:CH3COOH 在FeBr3催化作用下,与液溴反应的化学方程式为:
在FeBr3催化作用下,与液溴反应的化学方程式为: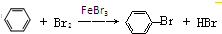 .
.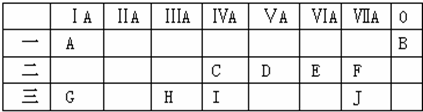
 ,元素H与元素J组成的化合物的水溶液中加入少量烧碱溶液,反应的离子方程式为Al3++3OH-=Al(OH)3↓.
,元素H与元素J组成的化合物的水溶液中加入少量烧碱溶液,反应的离子方程式为Al3++3OH-=Al(OH)3↓. .
.