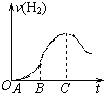
题目内容
1.X、Y为两种元素的原子,X的阴离子与Y的阳离子具有相同的电子层结构,下列判断错误的是( )| A. | X的电负性大于Y的电负性 | B. | X的原子半径大于Y的原子半径 | ||
| C. | X的氧化性大于Y的氧化性 | D. | X的第一电离能大于Y的第二电离能 |
分析 X元素的阴离子和Y元素的阳离子具有相同的电子层结构,离子核外电子数目相等,则Y元素处于X元素的下一周期,X为非金属元素,最外层电子数较多,Y为金属元素,最外层电子数相对较少.
解答 解:X元素的印离子和Y元素的阳离子具有相同的电子层结构,离子核外电子数目相等,则Y元素处于X元素的下一周期,X为非金属元素,最外层电子数较多,Y为金属元素,最外层电子数相对较少,
A、X为非金属元素,Y为金属元素,故X的电负性高于Y的电负性,故A正确;
B、Y元素处于X元素的下一周期,X为非金属元素,原子半径小于同周期与Y处于同族的元素,故原子半径Y>X,故B错误;
C、X为非金属元素,Y为金属元素,故X的氧化性强于Y的氧化性,故C正确;
D、X为非金属元素,Y为金属元素,故X的第一电离能大于Y的第一电离能,故D正确;
故选B.
点评 本题考查结构与位置的关系、半径与电负性、第一电离能比较等,难度不大,关键根据离子具有相同的电子层结构推断元素的相对位置.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
请回答:
(1)X2Z的电子式是 ;M2Z中所含化学键类型是离子键.
;M2Z中所含化学键类型是离子键.
(2)Y的非金属性比N强(填“强”或“弱”),能证明此结论的事实是CO 2+H 2O+SiO32-=H 2SiO 3↓+CO 32-(用离子方程式表示).
(3)YX4的结构简式为CH4;分子里各原子的空间分布具有正四面体结构;在光照的条件下,将1mol YX4与1mol Cl2混合充分反应后,得到的产物最多有5种.
| 元素 | 有关信息 |
| X | 在元素周期表中原子半径最小 |
| Y | 最外层电子数是次外层的2倍 |
| Z | 元素的主要合价为一2价 |
| M | 其单质及化合物的焰色反应呈黄色 |
| N | 与Y同主族,其单质为半导体 |
(1)X2Z的电子式是
 ;M2Z中所含化学键类型是离子键.
;M2Z中所含化学键类型是离子键.(2)Y的非金属性比N强(填“强”或“弱”),能证明此结论的事实是CO 2+H 2O+SiO32-=H 2SiO 3↓+CO 32-(用离子方程式表示).
(3)YX4的结构简式为CH4;分子里各原子的空间分布具有正四面体结构;在光照的条件下,将1mol YX4与1mol Cl2混合充分反应后,得到的产物最多有5种.
12.卤族元素的单质、化合物在生产生活中有较多的用途.
(1)卤族元素位于元素周期表的p区;溴的价电子排布式为4s24p5
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键
(3)根据第一电离能(数据见下表),最有可能生成稳定单核阳离子的卤素原子是I
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图Ⅰ、Ⅱ所示:
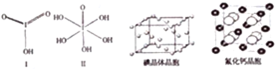
则二者酸性相对强弱是HIO3>H5IO6(填“>”、“<”或“=”).
(5)已知ClO2-为V形结构,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3与ClO2-为等电子体的是Cl2O或OF2(写出其中一个的化学式)
(6)关于碘晶体(晶体结构见上图)的以下说法中正确的是AD
A.2种取向不同排列的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(晶胞结构见上图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为acm,则CaF2的相对分子质量可以表示为$\frac{a{\;}^{3}ρN{\;}_{A}}{4}$.
(1)卤族元素位于元素周期表的p区;溴的价电子排布式为4s24p5
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键
(3)根据第一电离能(数据见下表),最有可能生成稳定单核阳离子的卤素原子是I
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |

则二者酸性相对强弱是HIO3>H5IO6(填“>”、“<”或“=”).
(5)已知ClO2-为V形结构,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3与ClO2-为等电子体的是Cl2O或OF2(写出其中一个的化学式)
(6)关于碘晶体(晶体结构见上图)的以下说法中正确的是AD
A.2种取向不同排列的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(晶胞结构见上图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为acm,则CaF2的相对分子质量可以表示为$\frac{a{\;}^{3}ρN{\;}_{A}}{4}$.
9.下列有关物质分类正确的是( )
| A. | 液氯、晶体硅、臭氧均属于单质 | B. | 盐酸、醋酸、苯酚均属于强电解质 | ||
| C. | CO2、CCl4、蛋白质均属于有机物 | D. | CuO、MgO、Na2O2均属于碱性氧化物 |
16.在下列自然资源的开发利用中,不涉及化学变化的是( )
| A. | 分馏石油获得汽油、煤油和柴油 | |
| B. | 干馏煤获得焦炉煤气、煤焦油和焦炭 | |
| C. | 以煤、石油和天然气为原料生产合成材料 | |
| D. | 从海水中提取溴 |
6.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.以下叙述正确的是( )
| A. | 油脂的水解产物为葡萄糖 | B. | 蔗糖水解的最终产物是葡萄糖 | ||
| C. | 常温下,淀粉遇碘变蓝色 | D. | 蛋白质烧焦时没有特殊气味 |
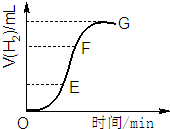 用不纯的锌粒与2mol/L盐酸反应制取氢气气体,请回答:
用不纯的锌粒与2mol/L盐酸反应制取氢气气体,请回答: