题目内容
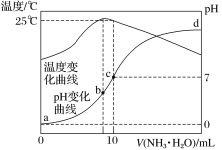
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中 ( )。
A.水的电离程度始终增大
B.![]() 先增大再减小
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c(NH![]() )=c(CH3COO-)
)=c(CH3COO-)
【答案】D
【解析】
试题分析:A、CH3COOH属于弱酸,抑制水的电离,加入NH3·H2O,消耗CH3COOH,水的电离程度增大,但氨水过量后,对水电离抑制,故错误;B、当向CH3COOH溶液中滴加相同浓度的NH3·H2O,开始时溶液为CH3COOH和CH3COONH4的混合物,由CH3COONH4的水解常数Kh=[c(H+)×c(NH3·H2O)]/c(NH4+),随着氨水的加入,c(H+)逐渐减小,Kh不变,因此c(NH4+)/c(NH3·H2O)变小,当氨水至溶液显碱性时,氨水的电离常数Kb=[c(OH-)×c(NH4+)]/c(NH3·H2O),随着氨水的加入,c(OH-)逐渐增大,Kb不变,c(NH4+)/c(NH3·H2O)变小,因此此比值始终变小;C、根据物料守恒,n(CH3COOH)+n(CH3COO-)=0.001mol,由于溶液体积逐渐增大,因此c(CH3COOH)和c(CH3COO-)之和逐渐减小,故错误;D、当加入氨水的体积为10mL,醋酸和NH3·H2O物质的量相等,由于二者电离常数相等,因此溶液显中性,c(H+)=c(OH-),根据电荷守恒,c(NH4+)=c(CH3COO-),故正确。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有Fe2O3、CuO、SiO2等杂成) 制备ZnSO4 ·7H2O的流程如下。
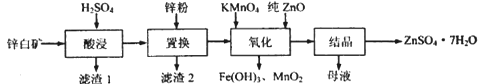
相关金属离了生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 6.4 | 8.0 |
(1)“滤渣1”的主要成分为_________(填化学式)。“酸浸”过程中,提高锌元素浸出率的措施有:适当提高酸的浓度、______________(填一种)。
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为__________________________。
(3)“氧化”一步中,发生反应的离子方程式为_______________________。溶液pH控制在[3.2,6.4)之间的目的是________________。
(4)“母液”中含有的盐类物质有_________ (填化学式)。