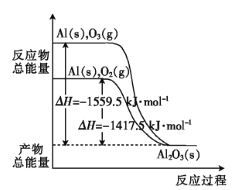
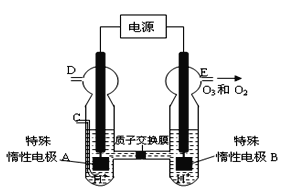
题目内容
【题目】下列说法正确的是( )
A.升高温度,Al2(SO4)3溶液的pH增大。
B.室温下,CuSO4溶液pH<7,因此向纯水中加入CuSO4会抑制水的电离。
C.Na2SiO3溶液加热、蒸干、灼烧后所得固体的成分是SiO2。
D.相同温度下,AgCl在相同物质的量浓度的CaCl2和NaCl溶液中的溶解度不同。
【答案】D
【解析】
试题分析:A、Al3+发生水解,Al3++3H2O![]() Al(OH)3+3H+,盐类水解是吸热反应,升高温度,促进电离,c(H+)增大,pH降低,故错误;B、CuSO4属于强酸弱碱盐,Cu2+发生水解,Cu2++2H2O
Al(OH)3+3H+,盐类水解是吸热反应,升高温度,促进电离,c(H+)增大,pH降低,故错误;B、CuSO4属于强酸弱碱盐,Cu2+发生水解,Cu2++2H2O![]() Cu(OH)2+2H+,c(H+)>c(OH-),溶液显酸性,即pH<7,盐类水解,促进水的电离,故错误;C、发生SiO32-+2H2O
Cu(OH)2+2H+,c(H+)>c(OH-),溶液显酸性,即pH<7,盐类水解,促进水的电离,故错误;C、发生SiO32-+2H2O![]() H2SiO3+2OH-,加热虽然促进水解,但蒸干、灼烧后,固体仍为Na2SiO3,故错误;D、相同浓度时,CaCl2溶液中c(Cl-)是NaCl溶液中c(Cl-)的2倍,根据Ksp(AgCl)=c(Ag+)×c(Cl-),因此AgCl在CaCl2溶液中的溶解度小于在NaCl溶液的溶解度,故正确。
H2SiO3+2OH-,加热虽然促进水解,但蒸干、灼烧后,固体仍为Na2SiO3,故错误;D、相同浓度时,CaCl2溶液中c(Cl-)是NaCl溶液中c(Cl-)的2倍,根据Ksp(AgCl)=c(Ag+)×c(Cl-),因此AgCl在CaCl2溶液中的溶解度小于在NaCl溶液的溶解度,故正确。

练习册系列答案
相关题目