题目内容
【题目】碱性硼化钒(VB2)—空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5,用该电池电解100mL 硫酸铜溶液,实验装置如图所示(b、c均为惰性电极),当外电路中通过0.02mol电子时,B装置两极共收集到0.224L气体(标准状况)。下列说法正确的是( )
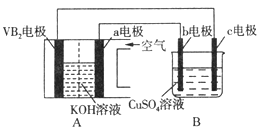
A. 电解过程中,b电极表面先有红色物质析出,然后有气泡产生
B. VB2为负极,电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+
C. 电池内部OH-移向a电极,溶液pH保持增大
D. 忽略溶液体积变化,电解后B装置中溶液的pH为1
【答案】D
【解析】A.该题A装置为原电池,通入空气的a电极为正极,与电源正极相连的b电极为阳极,电解时,溶液中的OH-在阳极放电生成氧气,即b电极表面没有红色物质析出,故A错误;B.根据上述分析,a电解为正极,则VB2电极是负极,负极上是VB2失电子发生氧化反应,则VB2极发生的电极反应为:2VB2+22OH--22e-=V2O5+2B2O3+11H2O,故B错误;C.根据上述分析,a电极为正极,电池内部OH-移向a电极,根据燃料电池的总反应,溶液pH保持不变,故C错误;D.当外电路中通过0.02mol电子时,B装置内b为阳极,电极反应为4OH--4e-=2H2O+O2,氢氧根失电子生成氧气为0.005mol,共收集到0.224L气体,物质的量为0.224L÷22.4L/mol= 0.01mol,则阴极也产生0.005moL的氢气,所以溶液中生成H+的物质的量为0.02-0.005×1=0.01mol,溶液中c(H+)=0.01mol÷0.1L=0.1mol/L,pH=1,故D正确;故选D。

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目