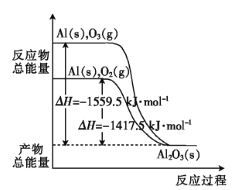
题目内容
【题目】在某温度时,将n mol·L-1氨水滴入10mL 1.0mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是:
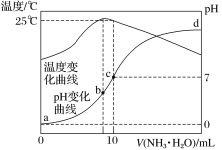
A.a点Kw=1.0×10-14
B.水的电离程度:c > b >a>d
C.b点:c(NH![]() )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)
D.25℃时,NH4Cl水解常数Kh= ![]() mol·L-1 (用含n的代数式表示)
mol·L-1 (用含n的代数式表示)
【答案】D
【解析】
试题分析:A.水的离子积与温度有关,a点时溶液温度小于25℃,则水的离子积Kw<1.0×10-14 mol2L-2,故A错误;B.b点溶液温度最高,说明此时两溶液恰好反应生成氯化铵,铵根离子水解促进了水的电离,则a、d两点都抑制了水的电离,则b点水的电离程度最大;由于d点混合液的pH不知,则无法判断a、d两点水的电离程度大小,故B错误;C.b点时溶液的pH<7,则c(OH-) >c(H+),根据电荷守恒可知:c(NH![]() )>c(Cl-),溶液中正确的离子浓度大小为:c(NH
)>c(Cl-),溶液中正确的离子浓度大小为:c(NH![]() )>c(Cl-) >c(OH-) >c(H+),故C错误;D.根据图象可知,25℃时溶液的pH=7,则:c(OH-)=c(H+)=10-7 molL-1,c(NH
)>c(Cl-) >c(OH-) >c(H+),故C错误;D.根据图象可知,25℃时溶液的pH=7,则:c(OH-)=c(H+)=10-7 molL-1,c(NH![]() )=c(Cl-)=0.05mol/L,根据物料守恒可知:c(NH3H2O)=(0.5n-0.05)mol/L,则25℃时NH4Cl水解常数为:K=(0.05×107)/( (0.5n0.05))=10-7/ (10n1),故D正确。故选D。
)=c(Cl-)=0.05mol/L,根据物料守恒可知:c(NH3H2O)=(0.5n-0.05)mol/L,则25℃时NH4Cl水解常数为:K=(0.05×107)/( (0.5n0.05))=10-7/ (10n1),故D正确。故选D。

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目