题目内容
14.铜有两种天然同位素${\;}_{29}^{63}$Cu和${\;}_{29}^{65}$Cu,已知铜元素的近似相对原子质量为63.5,则${\;}_{29}^{63}$Cu的原子个数百分数是( )| A. | 75% | B. | 25% | C. | 50% | D. | 45% |
分析 元素的相对原子质量是其各种同位素相对原子质量的加权平均值.设63Cu原子的原子个数百分比为x,则65Cu的原子个数百分比为1-x,则63x+65(1-x)=63.5,以此来解.
解答 解:设63Cu原子的原子个数百分比为x,则65Cu的原子个数百分比为1-x,
铜的相对原子质量为63.5,则
63x+65(1-x)=63.5,
解得x=75%,
故选A.
点评 本题考查相对原子质量的有关计算,难度不大,把握元素相对原子质量的定义及计算式为解答的关键.

练习册系列答案
相关题目
5.已知价电子数相同的离子或分子结构相似,如SO3、NO3-都是平面三角形.那么下列分子或离子中与SO42-有相似结构的是( )
| A. | PCl5 | B. | CCl4 | C. | NF3 | D. | N3- |
2.在一密闭容器中,反应mA(g)+nB(s)?3C(g)达到平衡时,测得C(A)为0.5mol/L在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得C(A)为0.3mol/L,则下列判断不正确的是( )
| A. | 混合气体密度一定减小 | B. | 平衡一定向逆反应方向移动 | ||
| C. | 化学计量数:m+n<3 | D. | 物质C的体积分数减小了 |
19.下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥浓HNO3,其中在一定条件下能与SiO2反应的有( )
| A. | ①②⑥ | B. | ②③⑥ | C. | ①③④⑤ | D. | 全部 |
6.25℃时,在0.01 mol•L-1的硫酸溶液中,水电离出的H+浓度是( )
| A. | 5×10-13 mol•L-1 | B. | 0.02 mol•L-1 | ||
| C. | 1×10-7 mol•L-1 | D. | 1×10-12 mol•L-1 |
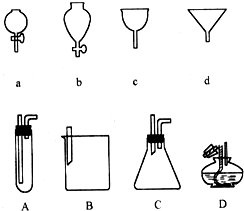 如图a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,如:C与a组合,用于制取气体.
如图a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,如:C与a组合,用于制取气体.