题目内容
15.配平下列方程式:(1)3Ag+4HNO3--3AgNO3+1NO↑+2H2O
(2)2KMnO4+10FeSO4+8H2SO4--5Fe2(SO4)3+1K2SO4+2MnSO4+8H2O
(3)3P4+10HClO3+18H2O--12H3PO4+10HCl
(4)2KMnO4+5H2S+3H2SO4--2MnSO4+5S↓+1K2SO4+8H2O
(5)3As2S3+28HNO3+4H2O--6H3AsO4+9H2SO4+28NO↑
(6)5NH4NO3--4N2↑+2HNO3+9H2O
(7)1Cr2O72-+6I-+14H+--2Cr3++3I2+7H2O
(8)6NO3-+5CH30H--3N2+5CO2+7H2O+6OH-.
分析 在氧化还原反应中,氧化剂得电子数等于还原剂失去电子数,根据转移电子守恒及原子守恒、电荷守恒配平方程式.
解答 解:(1)Ag+HNO3--AgNO3+NO↑+H2O中Ag元素化合价由0价变为+1价、部分N元素化合价由+5价变为+2价,其转移电子数为3,再结合原子守恒配平方程式为3Ag+4HNO3=3AgNO3+NO↑+2H2O,
故答案为:3;4;3;1;2;
(2)KMnO4+FeSO4+H2SO4--Fe2(SO4)3+K2SO4+MnSO4+H2O中Mn元素化合价由+7价变为+2价、Fe元素化合价由+2价变为+3价,转移电子数为10,再结合原子守恒配平方程式为
2KMnO4+10FeSO4+8H2SO4=5Fe2(SO4)3+K2SO4+2MnSO4+8H2O,
故答案为:2;10;8;5;1;2;8;
(3)P4+HClO3+H2O--H3PO4+HCl中P元素化合价由0价变为+5价、Cl元素化合价由+5价变为-1价,转移电子数为60,根据转移电子守恒、原子守恒配平方程式为3P4+10HClO3+18H2O=12H3PO4+10HCl,故答案为:3;10;18;12;10;
(4)KMnO4+H2S+H2SO4--MnSO4+S↓+K2SO4+H2O中Mn元素化合价由+7价变为+2价、S元素化合价由-2价变为0价,转移电子数为10,根据转移电子守恒、原子守恒配平方程式为2KMnO4+5H2S+3H2SO4=2MnSO4+5S↓+K2SO4+8H2O,故答案为:2;5;3;2;5;1;8;
(5)As2S3+HNO3+H2O--H3AsO4+H2SO4+NO↑中As元素化合价由+3价变为+5价、S元素化合价由-2价变为+6价、N元素化合价由+5价变为+2价,转移电子数为84,根据转移电子守恒及原子守恒配平方程式为3As2S3+28HNO3+4H2O=6H3AsO4+9H2SO4+28NO↑,
故答案为:3;28;4;6;9;28;
(6)NH4NO3--N2+HNO3+H2O中N元素化合价由-3价、+5价变为0价,转移电子数为15,根据转移电子守恒、原子守恒配平方程式为5NH4NO3=4N2↑+2HNO3+9H2O,故答案为:5;4;2;9;
(7)Cr2O72-+I-+H+--Cr3++I2+H2O中Cr元素化合价由+6价变为+3价、I元素化合价由-1价变为0价,转移电子数为6,根据转移电子守恒、原子守恒配平方程式为Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,故答案为:1;6;14;2;3;7;
(8)NO3-+CH30H--N2+CO2+H2O+OH-中N元素化合价由+5价变为0价、C元素化合价由-2价变为+4价,转移电子数为30,根据转移电子相等、原子守恒配平方程式为6NO3-+5CH30H=3N2↑+5CO2↑+7H2O+6OH-,故答案为:6;5;3;5;7;6.
点评 本题考查氧化还原反应方程式的配平,明确元素化合价变化是解本题关键,根据转移电子守恒、原子守恒、电荷守恒进行配平,歧化反应先配平生成物、归一反应先配平反应物,有机物中C元素采用平均化合价,题目难度中等.

 字词句段篇系列答案
字词句段篇系列答案| A. | 5×10-13 mol•L-1 | B. | 0.02 mol•L-1 | ||
| C. | 1×10-7 mol•L-1 | D. | 1×10-12 mol•L-1 |
| A. | 电解质与非电解质的本质区别,是在水溶液中或熔融状态下能否电离 | |
| B. | 在水溶液中和熔融状态下都能导电的化合物叫电解质 | |
| C. | 酸、碱和盐类都属于电解质,其他化合物都是非电解质 | |
| D. | 常见的强酸、强碱和大部分盐都是电解质,其他化合物都是非电解质 |
| A. | 碳酸钡与盐酸反应 | B. | 碳酸钾溶液与醋酸溶液反应 | ||
| C. | 苏打溶液与稀硝酸反应 | D. | 小苏打溶液与稀硫酸反应 |
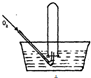 将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )
将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )| A. | 49mL | B. | 28 mL | C. | 30mL | D. | 24.5mL |
| A. | 碳原子采取sp杂化 | B. | CO2晶胞是体心结构 | ||
| C. | 干冰是原子晶体 | D. | CO2为极性分子 |
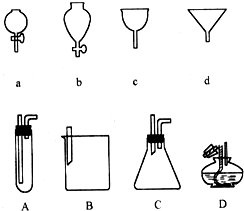 如图a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,如:C与a组合,用于制取气体.
如图a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,如:C与a组合,用于制取气体.