题目内容
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH=?的化学反应,下列叙述不正确的是
| A.反应过程中能量关系如上图表示,则该反应为放热反应 |
| B.若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
| C.化学反应的焓变与反应方程式的计量系数有关 |
| D.若将该反应设计成原电池,锌为负极 |
B
解析试题分析:A选项反应物能量高于生成物能量,为放热反应,正确。B选项没有标准状况,无法换算,错误。C选项满足反应热的定义,正确、D选项Zn失去电子,作负极,正确。
考点:化学反应中能量的变化过程。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
如图所示是298 K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是( ) 
A.该反应的热化学方程式为:N2+3H2 2NH3 ΔH=-92 kJ/mol 2NH3 ΔH=-92 kJ/mol |
| B.a曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热改变 |
| D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |
下列与化学反应能量变化相关的叙述中正确的是
| A.已知CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802 kJ/mol,甲烷的燃烧热为802 kJ/mol |
| B.等量H2在O2中完全燃烧,生成H2O(g)比生成H2O(l)放出的热量多 |
| C.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| D.由石墨比金刚石稳定可知:C(金刚石, s)=C(石墨, s) ΔH<0 |
CH4、H2、CO的燃烧热分别为890.31kJ/mol、285.8kJ/mol、110.5 kJ/mol,下列热化学方程式书写正确的是
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.31kJ/mol |
| B.2H2(g)+ O2(g)= 2H2O(l)ΔH=-285.8kJ/mol |
| C.CO (g)+ H2O(g)= CO2(g)+ H2 (g)ΔH=+175.3kJ/mol |
| D.2CO (g)+ O2(g) = 2CO2(g)ΔH="-221" kJ/mol |
下列与化学反应能量变化相关的叙述正确的是
| A.反应物的总能量一定高于生成物的总能量 |
| B.铝与氧化铁反应既是氧化还原反应,又是吸热反应 |
| C.化学反应中发生能量变化的根本原因是化学键的断裂与形成 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
下列热化学方程式正确的是(注: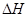 的绝对值均正确)( )
的绝对值均正确)( )
| A.C2H5OH(l)+3O2(g)=2CO2(g) +3H2O(g);△H=" —1367.0" kJ/mol(燃烧热) |
| B.NaOH(aq) + HCl(aq)="NaCl(aq)" + H2O(l);△H= —57.3kJ/mol(中和热) |
| C.S(s) + O2(g) = SO2(g);△H= —269.8kJ/mol(反应热) |
| D.2HCl(g)=Cl2(g) + H2(g);△H=" —" 184.6kJ/mol(反应热) |
1克氢气燃烧生成液态水放出142.9 kJ热量,表示该反应的热化学方程式正确的是( )
| A.2H2(g)+O2(g)=2H2O(l);△H="-285.8" kJ/mol |
| B.H2(g)+1/2O2(g)=H2O(g);△H=-142.9kJ/mol |
| C.H2O(l)=H2(g)+1/2O2(g); △H="+285.8" kJ/mol |
| D.2H2+O2=2H2O;△H="-571.6" kJ/mol |
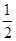 O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2