题目内容
CH4、H2、CO的燃烧热分别为890.31kJ/mol、285.8kJ/mol、110.5 kJ/mol,下列热化学方程式书写正确的是
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.31kJ/mol |
| B.2H2(g)+ O2(g)= 2H2O(l)ΔH=-285.8kJ/mol |
| C.CO (g)+ H2O(g)= CO2(g)+ H2 (g)ΔH=+175.3kJ/mol |
| D.2CO (g)+ O2(g) = 2CO2(g)ΔH="-221" kJ/mol |
D
解析试题分析:燃烧热是1mol的物质完全燃烧产生稳定的氧化物时所放出的热量。A产生的气态水不是稳定的状态。错误。B.1mol H2燃烧产生液态水放出热量285.8kJ,则2mol H2燃烧产生液态水放出热量571.6kJ.所以热化学方程式2H2(g)+ O2(g)= 2H2O(l) ΔH=-571.6kJ/mol。错误。C。H2不是氧化物。错误。D.符合燃烧热及相应的物质的量的关系。正确。
考点:考查燃烧热与热化学方程式的书写的知识。

在298 K、100 kPa时,已知:
① 2H2O(g)=O2(g)+2H2(g) ΔH1 ② Cl2(g)+H2(g)=2HCl(g) ΔH2
③ 2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
| A.ΔH3=ΔH1+2ΔH2 | B.ΔH3=ΔH1+ΔH2 | C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1-ΔH2 |
已知反应:H2(g) + 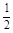 O2(g) = H2O(g) △H1
O2(g) = H2O(g) △H1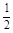 N2(g) + O2(g) = NO2 (g) △H2
N2(g) + O2(g) = NO2 (g) △H2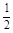 N2(g) +
N2(g) + 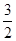 H2(g) = NH3 (g) △H3
H2(g) = NH3 (g) △H3
则反应2NH3 (g) +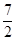 O2(g) =2NO2 (g) +3H2O(g) 的△H=
O2(g) =2NO2 (g) +3H2O(g) 的△H=
| A.2△H1+2△H2—2△H3 | B.△H1+△H2—△H3 |
| C.3△H1+2△H2+2△H3 | D.3△H1+2△H2—2△H3 |
心脏起搏器电源—锂碘电池的电池反应为:2 Li(s) + I2 (s) =" 2" LiI(s) ΔH
已知:4 Li(s) + O2 (g) =" 2" Li2O(s) ΔH1
4 LiI(s) + O2 (g) =" 2" I2 (s) + 2 Li2O(s) ΔH2 则下列说法正确的是( )
| A.ΔH=1/2ΔH1 -ΔH2 | B.ΔH=1/2ΔH1 +ΔH2 |
| C.ΔH=1/2ΔH1 -1/2ΔH2 | D.ΔH=1/2ΔH1 +1/2ΔH2 |
已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
| A.-44.2 kJ·mol-1 | B.+44.2 kJ·mol-1 | C.-330 kJ·mol-1 | D.+330 kJ·mol-1 |
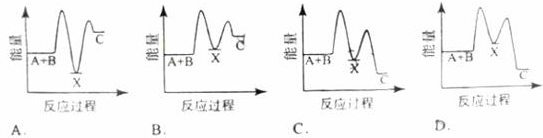
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH=?的化学反应,下列叙述不正确的是
| A.反应过程中能量关系如上图表示,则该反应为放热反应 |
| B.若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
| C.化学反应的焓变与反应方程式的计量系数有关 |
| D.若将该反应设计成原电池,锌为负极 |