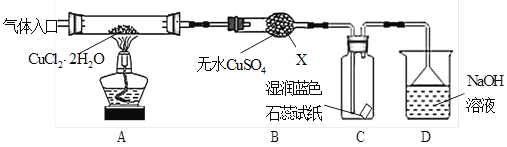
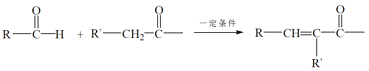题目内容
【题目】工业上电解制碱的技术是用阳离子交换膜法,主要原料是饱和食盐水。图一为阳离子交换膜法电解原理示意图。请回答下列问题:
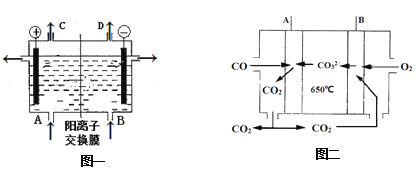
(1)反应的离子方程式是___。A、B、C、D所对应物质化学式分别为__________、____、______、_______,每通过0.1mol电子,就有0.1mol____(填离子符号)通过离子交换膜。
(2)若上述电解过程中用阴离子交换膜代替阳离子交换膜(已知:3Cl2 +6OH- = 5Cl-+ClO3-+3H2O),下列说法正确的组合是___________。
A.电解结束时,右侧溶液中含有ClO3—
B.电解槽内发生反应的总化学方程式为:NaCl + 3H2O ![]() NaClO3 + 3H2↑
NaClO3 + 3H2↑
C.用阴离子交换膜后,电解槽内两个电极发生的电极反应与原来一样
D.用阴离子交换膜后,阳离子的定向移动方向与原来相反
(3)如果用熔融碳酸盐CO燃料电池供电,图二为其工作原理,A、B极的电极反应分别是____、_______________。
【答案】2Cl-+2H2O 电解 2OH-+H2↑+Cl2↑ NaCl NaOH Cl2 H2 Na+ ABC 2CO+2CO32- - 4e- = 4CO2 O2+2CO2+4e- =2CO32-
【解析】
(1)根据题中信息,对饱和食盐水进行电解,制取碱,反应的离子方程式是2Cl-+2H2O 电解 2OH-+H2↑+Cl2↑;根据装置图结构,左边电极与电源正极相连,故左边的电极为阳极,阴离子在该电极失电子发生氧化反应,右边的电极与电源的负极相连,右边电极为阴极,阳离子在该电极得电子,发生还原反应,根据化学反应方程式得失电子可得,阳极生成氯气,阴极生成氢气和氢氧化钠,阳离子向阴极移动,A应补充NaCl,B补稀的NaOH,因此电解时,A为NaCl,B为NaOH,C为 Cl2,D为H2,电解池中间为阳离子交换膜,只允许阳离子通过,该电解池中的阳离子主要为钠离子。当每通过0.1mol电子,就有0.1mol Na+通过离子交换膜。
答案为: 2Cl-+2H2O 电解 2OH-+H2↑+Cl2↑;NaCl; H2O;Cl2; H2; Na+
(2)A.电解时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气同时电极附近生成氢氧根离子,氢氧根离子通过阴离子交换膜移向阳极,氯气和氢氧根离子反应生成氯酸根离子,电解结束时,溶液呈电中性,则右侧溶液中含有ClO3-,故A正确;
B.电解时,阴极上氢离子放电,阳极上氯离子放电生成氯酸根离子,电池反应式为:NaCl + 3H2O ![]() NaClO3 + 3H2↑,故B正确;
NaClO3 + 3H2↑,故B正确;
C.无论使用阴离子交换膜还是阳离子交换膜,阳极上都是氯离子放电、阴极上都是氢离子放电,所以电解槽内两个电极发生的电极反应与原来一样,故C正确;
D.无论使用阴离子交换膜还是阳离子交换膜,阳离子都向阴极移动,故D错误;
答案为:ABC。
(3)根据图二其工作原理,A电极上CO和CO32-转变为CO2,碳的化合价+2价变为+4价,化合价升高失电子,发生氧化反应,故A为负极;B电极上O2和CO2转变为CO32-,样的化合价从0价变为-2价,化合价降低得电子,发生还原反应,B为正极。电极反应分别是A:2CO+2CO32- - 4e- = 4CO2 ,B:O2+2CO2+4e- =2CO32-;
答案为:2CO+2CO32- - 4e- = 4CO2;O2+2CO2+4e- =2CO32-