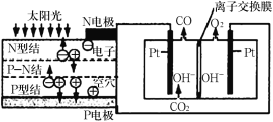
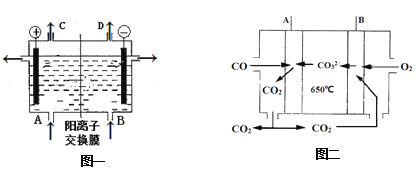
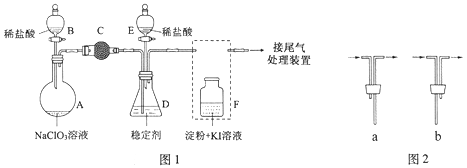
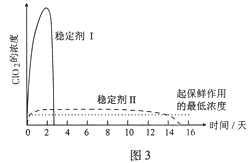
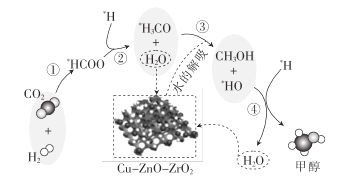
题目内容
【题目】有碳酸钠、碳酸氢钠的混合物19.0g,把它们加热到质量不再减轻,冷却后称量为15.9g。求:
(1)原混合物中碳酸钠的质量分数_________。(写出计算过程,结果保留3位有效数字)
(2)将原混合物19.0g完全溶解于蒸馏水水中,配成500mL溶液,则其中钠离子物质的量浓度为______________________。
【答案】混合物加热只有碳酸氢钠分解:![]() ,减少的质量(19.0-15.9)g为水和二氧化碳的质量,
,减少的质量(19.0-15.9)g为水和二氧化碳的质量,
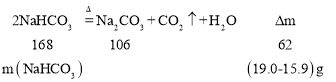
168:62=m(NaHCO3):3.1g,解得m(NaHCO3) =8.4g,则碳酸钠为19.0-8.4=10.6g,所以碳酸钠的质量分数为![]() ×100%=55.8%
×100%=55.8%
答:原混合物中碳酸钠的质量分数约是55.8%。 0.600 mol·L-1
【解析】
(1)混合物加热只有碳酸氢钠分解:![]() ,减少的质量为水和二氧化碳的质量,根据方程式计算碳酸氢钠的质量,进而计算碳酸钠的质量分数;
,减少的质量为水和二氧化碳的质量,根据方程式计算碳酸氢钠的质量,进而计算碳酸钠的质量分数;
(2)计算碳酸氢钠、碳酸钠的物质的量,可知溶液中钠离子物质的量总量,根据定义式计算钠离子物质的量浓度。
(1)混合物加热只有碳酸氢钠分解:![]() ,减少的质量(19.0-15.9)g为水和二氧化碳的质量,
,减少的质量(19.0-15.9)g为水和二氧化碳的质量,
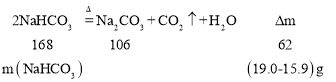
168:62=m(NaHCO3):3.1g,解得m(NaHCO3) =8.4g,则碳酸钠为19.0-8.4=10.6g,所以碳酸钠的质量分数为![]() ×100%=55.8%
×100%=55.8%
答:原混合物中碳酸钠的质量分数约是55.8%。
(2)190g原混合物中n(Na2CO3)=![]() =0.11mol,n(NaHCO3)=
=0.11mol,n(NaHCO3)=![]() =0.1mol,故溶液中n(Na+)=0.1mol×2+0.1mol=0.3mol,溶液中c(Na+)=
=0.1mol,故溶液中n(Na+)=0.1mol×2+0.1mol=0.3mol,溶液中c(Na+)=![]() =0.6mol/L。
=0.6mol/L。

练习册系列答案
相关题目