题目内容
下列叙述正确的是( )
| A.越难失电子的元素得电子能力一定越强 |
| B.溶于水可以导电的化合物一定是离子化合物 |
| C.第三周期元素的最高正化合价等于它所处的主族序数 |
| D.离子化合物中可以含有共价键,共价化合物可以含有离子键 |
C
解析试题分析:A.元素的越难失电子,则其离子得电子能力一定越强。错误。B.在水溶液中能够导电的化合物可能是离子化合物,也可能是共价化合物。错误。C.对于第三周期的主族元素来说,原子的最外层电子数等于其最高化合价数,也等于其主族序数。因此元素的最高正化合价等于它所处的主族序数。正确。D.离子化合物中可以含有共价键,但是共价化合物一定不能含有离子键。错误。
考点:考查元素的原子结构与化合价、形成的化合物的性质的关系的知识。

练习册系列答案
 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中不正确的是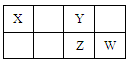
| A.Y与Z形成的化合物是形成酸雨的原因之一 |
| B.W的单质能与水反应,生成一种具有漂白性的物质 |
| C.最高价氧化物对应水化物的酸性:W >Z >X |
| D.气态氢化物的稳定性:W > Z >Y |
.运用元素周期律分析下面的推断,其中错误的是
| A.砹(85号元素)是一种有色固体,HAt应该不稳定,且AgAt是有色难溶于水固体 |
| B.铍(Be)是一种金属,它的氧化物的水化物可能具有两性 |
| C.硫酸锶(SrSO4)是难溶于水和盐酸的的白色固体 |
| D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 |
现有五种短周期元素X、Y、Z、Q、W,原子序数依次增大,在周期表中X原子半径最小;X和W同主族;Y元素原子核外电子总数是其次外层电子数的3倍;Q元素是地壳中含量最高的元素。下列说法不正确的是
| A.原子半径:Y<Q<W |
| B.ZX3可使紫色石蕊溶液变蓝 |
| C.X、Z、Q三种元素可组成离子化合物或共价化合物 |
| D.X2Q2、Y2X6两种分子中含有的电子数、化学键种类都相同 |
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍。下列判断正确的是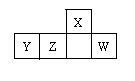
| A.原子半径:X>Y>Z>W |
| B.含Y元素的盐溶液有的显酸性,有的显碱性 |
| C.最简单气态氢化物的热稳定性:Z >W |
| D.X的氢化物能与其最高价氧化物对应的水化物反应生成盐 |
短周期元素X、Y、Z的原子序数依次增大,Y为IA族元素,X与Z同主族,3种元素原子的最外层电子数之和为13,下列判断正确的是
| A.Y元素位于第2周期 | B.Y、Z均能与X形成不只一种化合物 |
| C.X是ⅤA族元素 | D.氢化物的稳定性:HnZ > HnX |
短周期元素X、Y、Z三种原子核外电子总数为32,都可形成常温下气体单质。X原子最外层电子数是其内层电子数的3倍;Y的气态氢化物与其最高价氧化物对应的水化物恰好反应的产物只有一种A,A的水溶液显酸性。下列说法正确的是
| A.原子半径: Z>X >Y |
| B.X元素形成的单质其摩尔质量一定是32g·moL-1 |
| C.物质A中既含离子键又含共价键 |
| D.YX2、ZX2都有对应的含氧酸 |
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是
| A.Y元素最高价氧化物对应的水化物化学式H2YO4 |
| B.原子半径由大到小的顺序为:Z>Y> W |
| C.X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 |
| D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1︰2 |