题目内容
.运用元素周期律分析下面的推断,其中错误的是
| A.砹(85号元素)是一种有色固体,HAt应该不稳定,且AgAt是有色难溶于水固体 |
| B.铍(Be)是一种金属,它的氧化物的水化物可能具有两性 |
| C.硫酸锶(SrSO4)是难溶于水和盐酸的的白色固体 |
| D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 |
D
解析试题分析:A、砹(85号元素)是第七主族元素,根据第七主族元素的性质特征推断,它是一种有色固体,HAt应该不稳定,且AgAt是有色难溶于水固体,正确;B、.铍(Be)是一种金属,在元素周期表中与Al是对角线的位置关系,化学性质具有相似性,氢氧化铝具有两性,所以铍的氧化物的水化物可能具有两性,正确;C、第二主族元素的硫酸盐从上到下越来越难溶于水、盐酸,所以硫酸锶(SrSO4)是难溶于水和盐酸的的白色固体,正确;D、硒位于第六主族,同主族元素 的氢化物的稳定性从上到下越来越不稳定,所以硒化氢(H2Se)是比H2S不稳定的气体,错误,答案选D。
考点:考查同主族元素性质的推断

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
最近科学家发现了氧元素的一种新的粒子O4,对于这种新粒子,下列说法不正确的是( )
| A.它是氧气的一种同素异形体 | B.它是氧元素的一种同位素 |
| C.它的摩尔质量是64 g·mol-1 | D.它具有很强的氧化性 |
已知1—18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A.四种元素位于同一周期 | B.氢化物的稳定性:H2Y>HZ |
| C.离子的氧化性:aW3+>bX+ | D.a+3=c-2 |
下列叙述正确的是( )
| A.越难失电子的元素得电子能力一定越强 |
| B.溶于水可以导电的化合物一定是离子化合物 |
| C.第三周期元素的最高正化合价等于它所处的主族序数 |
| D.离子化合物中可以含有共价键,共价化合物可以含有离子键 |
铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,以下对铊的性质的推断不正确的是
| A.铊是易导电的银白色金属 | B.能生成+3价离子化合物 |
| C.T1(OH)3是两性氢氧化物 | D.Tl的失电子能力比Al强 |
下图是元素周期表的一部分,下列说法正确的是( )
| A.可在灰色区域“甲”中寻找催化剂 |
| B.离子半径:W-﹥Y3-﹥X+ |
| C.气态氢化物的稳定性:Z﹥W |
| D.工业上电解X和W化合物的水溶液制备X |
已知下列元素的原子半径如下表所示: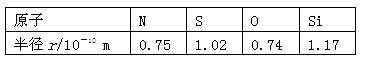
根据以上数据,磷原子的半径可能是
| A.1.10 ×10-10 m | B.0.80×10-10 m | C.1.20× 0-10 m | D.0.70×10-10 m |
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| C.由X元素形成的单质不一定是原子晶体 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
