题目内容
短周期元素X、Y、Z三种原子核外电子总数为32,都可形成常温下气体单质。X原子最外层电子数是其内层电子数的3倍;Y的气态氢化物与其最高价氧化物对应的水化物恰好反应的产物只有一种A,A的水溶液显酸性。下列说法正确的是
| A.原子半径: Z>X >Y |
| B.X元素形成的单质其摩尔质量一定是32g·moL-1 |
| C.物质A中既含离子键又含共价键 |
| D.YX2、ZX2都有对应的含氧酸 |
C
解析

练习册系列答案
相关题目
下列不能证明氯的非金属性比硫强的实验是
| A.HCl比H2S稳定 |
| B.HCl溶液(盐酸)的酸性比H2S溶液(氢硫酸)的酸性强 |
| C.HClO4溶液的酸性比H2SO4的酸性强 |
| D.氯气比硫有更强的氧化性 |
最近科学家发现了氧元素的一种新的粒子O4,对于这种新粒子,下列说法不正确的是( )
| A.它是氧气的一种同素异形体 | B.它是氧元素的一种同位素 |
| C.它的摩尔质量是64 g·mol-1 | D.它具有很强的氧化性 |
已知短周期元素的离子aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A.原子半径: A>B>D>C | B.原子序数: d>c>b>a |
| C.离子半径: C>D>B>A | D.单质的还原性: A>B>D>C |
外围电子构型为4d55s1的元素在周期表中的位置是
| A.第4周期第ⅠB族 | B.第5周期第ⅠB族 |
| C.第4周期第ⅥB族 | D.第5周期第ⅥB族 |
短周期元素R、T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角。下列判断正确的是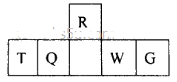
| A.离子半径:T< W<G |
| B.等物质的量的W、G单质分别与足量铁粉反应,后者消耗的铁粉多 |
| C.最简单气态氢化物的热稳定性:Q<R |
| D.T和G组成的化合物溶于水,其水溶液呈中性 |
已知1—18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A.四种元素位于同一周期 | B.氢化物的稳定性:H2Y>HZ |
| C.离子的氧化性:aW3+>bX+ | D.a+3=c-2 |
下列叙述正确的是( )
| A.越难失电子的元素得电子能力一定越强 |
| B.溶于水可以导电的化合物一定是离子化合物 |
| C.第三周期元素的最高正化合价等于它所处的主族序数 |
| D.离子化合物中可以含有共价键,共价化合物可以含有离子键 |
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| C.由X元素形成的单质不一定是原子晶体 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |