题目内容
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中不正确的是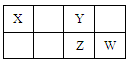
| A.Y与Z形成的化合物是形成酸雨的原因之一 |
| B.W的单质能与水反应,生成一种具有漂白性的物质 |
| C.最高价氧化物对应水化物的酸性:W >Z >X |
| D.气态氢化物的稳定性:W > Z >Y |
D
解析试题分析:由元素在周期表中的位置可知:Y是O;X是C;Z是S;W是Cl.A.O与S形成的化合物SO2是酸雨的原因之一。正确。B.氯气与水发生反应Cl2+H2O HCl+HClO,产生的HClO有强氧化性,是一种具有漂白性的物质。正确。C.元素的非金属性Cl>S>C.元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,所以最高价氧化物对应水化物的酸性:HClO4>H2SO4 >H2CO3。正确。D.元素的非金属性O>Cl>S. 元素的非金属性越强,其气态氢化物的稳定性就越强。所以氢化物的稳定性:H2O > HCl >H2S.错误。
HCl+HClO,产生的HClO有强氧化性,是一种具有漂白性的物质。正确。C.元素的非金属性Cl>S>C.元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,所以最高价氧化物对应水化物的酸性:HClO4>H2SO4 >H2CO3。正确。D.元素的非金属性O>Cl>S. 元素的非金属性越强,其气态氢化物的稳定性就越强。所以氢化物的稳定性:H2O > HCl >H2S.错误。
考点:考查元素周期表、元素周期律的的应用的知识。

练习册系列答案
相关题目
外围电子构型为4d55s1的元素在周期表中的位置是
| A.第4周期第ⅠB族 | B.第5周期第ⅠB族 |
| C.第4周期第ⅥB族 | D.第5周期第ⅥB族 |
已知1—18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A.四种元素位于同一周期 | B.氢化物的稳定性:H2Y>HZ |
| C.离子的氧化性:aW3+>bX+ | D.a+3=c-2 |
下列叙述正确的是( )
| A.越难失电子的元素得电子能力一定越强 |
| B.溶于水可以导电的化合物一定是离子化合物 |
| C.第三周期元素的最高正化合价等于它所处的主族序数 |
| D.离子化合物中可以含有共价键,共价化合物可以含有离子键 |
铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,以下对铊的性质的推断不正确的是
| A.铊是易导电的银白色金属 | B.能生成+3价离子化合物 |
| C.T1(OH)3是两性氢氧化物 | D.Tl的失电子能力比Al强 |
已知下列元素的原子半径如下表所示: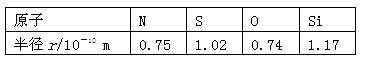
根据以上数据,磷原子的半径可能是
| A.1.10 ×10-10 m | B.0.80×10-10 m | C.1.20× 0-10 m | D.0.70×10-10 m |
下列有关物质性质的比较顺序中,不正确的是 ( )
| A.微粒半径:K+>Na+>Mg2+>Al3+ |
| B.热稳定性:HF<HCl<HBr<HI |
| C.酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
| D.熔点:Li>Na>K>Rb |
X、Y、Z、W四种短周期主族元素的原子序数依次增大,X在短周期主族元素中原子半径最大,Y是地壳中含量最高的金属元素,Z的最高正化合价与最低负化合价的代数和为4。下列说法正确的是
A.X的单质和水反应的离子方程式为 X+H2O===X-+OH-+H2 |
| B.Y的氧化物是碱性氧化物 |
| C.最高价氧化物对应水化物的碱性:X<Y |
| D.气态氢化物的稳定性:Z<W |
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是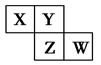
| A.元素Y和元素Z的最高正化合价相同 |
| B.单核阴离子半径的大小顺序为:r(W)>r(Y)>r(Z) |
| C.气态氢化物稳定性:X <Y<Z<W |
| D.元素W的最高价氧化物对应的水化物是强酸 |