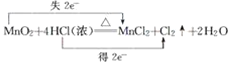
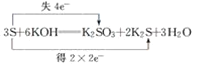
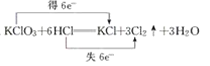
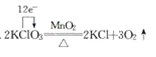
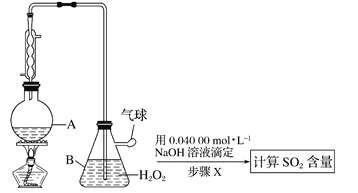
题目内容
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol/L,某同学进行了如下实验:
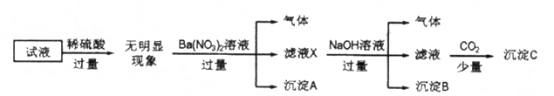
下列说法正确的是
A. 无法确定原试液中是否含有Al3+、Cl-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
D. 无法确定沉淀C的成分
【答案】C
【解析】
向该溶液中加入过量稀硫酸,无明显现象,说明没有CO32-、AlO2-;然后向该溶液中加入过量Ba(NO3)2溶液,产生沉淀A中一定含有BaSO4,同时有气体产生,说明溶液中含有还原性微粒Fe2+,与加入的H+、NO3-发生氧化还原反应产生NO气体,Fe2+被氧化变为Fe3+,向滤液X中加入过量的NaOH溶液,有气体产生,说明溶液中含NH4+,产生的气体是NH3,沉淀B中含Fe(OH)3,向滤液中通入少量CO2气体,在碱性条件下会与Ba2+发生反应形成BaCO3沉淀,离子浓度均为0.1mol/L,根据溶液呈电中性,已经确定含有的离子是NH4+、Fe2+,则还应该含有与二者不能发生反应的-1价的阴离子、-2价的阴离子,只能是Cl-、SO42-,故选项C正确。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案【题目】某学习小组为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,设计了如下实验。请补充完成该实验报告。
(1)(实验原理)
溶液的导电性由溶液中离子的浓度及离子电荷数决定。观察_____,据此判断溶液中自由移动的离子浓度的变化,从而证明反应是离子反应。
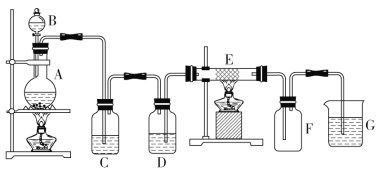
(2)(实验装置)如图1所示。

(实验过程与记录)
实验步骤 | 实验现象 | 实验结论 |
连接好装置,向烧杯中加入25mL1molL﹣1的Ba(OH)2溶液和2滴酚酞溶液,逐滴滴加1molL﹣1的H2SO4溶液直至过量,边滴边振荡。 | (2)_____(填写支持实验结论的证据) | Ba(OH)2溶液和H2SO4溶液的反应是离子反应 |
(3)整个过程中混合溶液的导电能力(用电流强度Ⅰ表示)可近似地用图2中的_____(填序号)曲线表示。
(4)下列三种情况下,与上述实验中离子方程式相同的是_____。
A 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42﹣恰好完全沉淀
B 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至至溶液显中性
C 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(5)已知:PbSO4难溶于水,但可溶于醋酸氨溶液中形成无色溶液,其化学方程式为:PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4.写出该反应的离子方程式为_____。