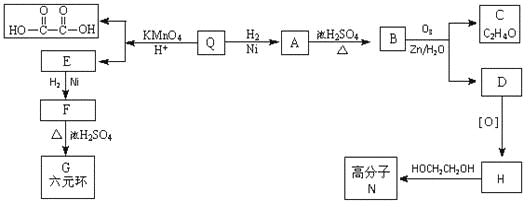
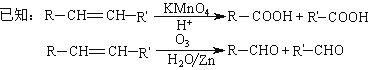题目内容
【题目】为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
(1)第①步中,操作A是________,第⑤步中,操作B用到的玻璃仪器是________。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)_________。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是_________。
(4)判断BaCl2已过量的方法是___________。
(5)下列是某学生设计操作A后混合液中Cl-、SO42-的检验步骤请根据内容填空:
①首先检验_________离子,应先加入过量的_____________。
②将所得混合物_________(填操作名称),然后在滤液中加入试剂_________检验另一离子。
【答案】溶解 漏斗、烧杯、玻璃棒 CaCl2+Na2CO3 =CaCO3↓+2NaCl、BaCl2+Na2CO3=BaCO3↓+2NaCl 操作③④中生成的Mg(OH)2、CaCO3、BaCO3沉淀会与盐酸反应生成可溶物质而无法过滤除去,从而影响精盐的纯度 取第②步后的上层清液,滴入几滴BaCl2溶液,看是否有白色沉淀生成,若无沉淀生成,则表明BaCl2已过量 SO42- Ba(NO3)2 HNO3 过滤 AgNO3(HNO3)
【解析】
由流程可知,首先应将粗盐进行溶解,则①中操作A为溶解,②中加入过量氯化钡溶液,生成硫酸钡沉淀,除去SO42-,③中加入过量NaOH溶液,生成Mg(OH)2沉淀,除去Mg2+,④中加入过量碳酸钠溶液,除去Ca2+以及过量的Ba2+,生成CaCO3、BaCO3沉淀,⑤中操作B为过滤,滤液中的溶质有氯化钠、过量的氢氧化钠以及过量的碳酸钠,再加盐酸后,与氢氧化钠、碳酸钠反应生成氯化钠,蒸发、结晶、烘干得到精盐,据此解答该题。
(1)由以上分析知,第①步中,操作A是溶解,第⑤步中,操作B是过滤,过滤需用到的玻璃仪器是漏斗、烧杯、玻璃棒,故答案为:溶解;漏斗、烧杯、玻璃棒;
(2)第④步中,加入过量碳酸钠溶液,除去Ca2+以及过量的Ba2+,则反应的化学方程式为CaCl2+Na2CO3 =CaCO3↓+2NaCl、BaCl2+Na2CO3=BaCO3↓+2NaCl,故答案为:CaCl2+Na2CO3 =CaCO3↓+2NaCl、BaCl2+Na2CO3=BaCO3↓+2NaCl;
(3)操作③④中生成Mg(OH)2、CaCO3、BaCO3沉淀,若先用盐酸调pH再过滤,则Mg(OH)2、CaCO3、BaCO3沉淀会与盐酸反应生成可溶物质而无法过滤除去,从而影响精盐的纯度,故答案为:操作③④中生成的Mg(OH)2、CaCO3、BaCO3沉淀会与盐酸反应生成可溶物质而无法过滤除去,从而影响精盐的纯度;
(4)若BaCl2已过量,说明操作②后,溶液中没有SO42-离子,因此检验溶液中是否含有SO42-离子即可,故答案为:取第②步后的上层清液,滴入几滴BaCl2溶液,看是否有白色沉淀生成,若无沉淀生成,则表明BaCl2已过量;
(5)①检验Cl-,一般用Ag+,检验SO42-,一般用Ba2+,Ag2SO4是微溶物,因此先检验SO42-,防止其他离子对实验的干扰,需要加入过量的Ba(NO3)2和HNO3溶液,如果得到沉淀,说明含有SO42-,故答案为:SO42-;Ba(NO3)2 HNO3;
②将所得混合物过滤,然后向滤液中加入AgNO3(HNO3)溶液,如果有白色沉淀产生,则说明有Cl-存在,故答案为:过滤;AgNO3(HNO3)。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案【题目】工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)△H
CH3OH(g)△H
(1)该反应的平衡常数表达式为_______;
(2)如表所列数据是反应在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H______0(填“>”、“=”或“<”);
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10s后达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为____,用H2表示反应速率为_____,此时的温度为______;
(3)要提高CO的转化率,可以采取的措施是______;
a.升温 b.加入催化剂 c.增加CO的浓度
d.恒容充入H2 e.恒压充入惰性气体 f.分离出甲醇
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS 等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_________________________;
(2)“溶解”时放出的气体为_______________ (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为______________________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式_____________;

(5)金属铬在溶液中有多种存在形式, CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应________________,根据A点数据计算出该转化反应的平衡常数为______________,温度升高,溶液中CrO42—的平衡转化率减小,则该反应的△H____0(填“>”、“<”或“=”)。