题目内容
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH- △H>0 ,下列叙述正确的是( )
H++OH- △H>0 ,下列叙述正确的是( )
A.向水中加入少量固体硫酸氢钠(忽略溶液温度改变),c(H+)增大,Kw不变
B.向水中加入少量的CH3COONa(忽略溶液温度改变),平衡向右移动,c(H+)增大
C.向水中加入稀氨水,平衡向左移动,c(OH―)降低
D.将水加热,c(H+)增大,c(OH―)降低,Kw增大
【答案】A
【解析】
水电离生成氢离子、氢氧根离子,所以加入能电离出氢离子或氢氧根离子的物质抑制水电离,加入和氢离子或氢氧根离子反应的物质能促进水电离,温度不变,离子积常数不变,据此分析解答。
A.向水中加入硫酸氢钠固体,硫酸氢钠电离出氢离子导致溶液中c(H+)增大,温度不变Kw不变,故A正确;
B.水中加入醋酸钠,醋酸钠为强碱弱酸盐,醋酸根水解促进水的电离,平衡向右移动,但c(H+)减小,故B错误;
C.向水中加入稀氨水,一水合氨电离出OH-而导致溶液中c(OH-)增大,从而抑制水电离,平衡向左移动,故C错误;
D.水的电离是吸热过程,升高温度促进水电离,则Kw增大,c(H+)增大,c(OH―)也增大,故D错误;
故答案为A。

 阅读快车系列答案
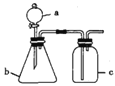
阅读快车系列答案【题目】装置a、b、c中分别盛有试剂1、2、3,用如图所示的装置进行实验(夹持仪器略去,必要时可加热),能达到相应实验目的的是
选项 | 试剂1 | 试剂2 | 试剂3 | 实验目的 | 装置 |
A | 浓 | Cu片 | KI-淀粉溶液 | 验证 |
|
B | 盐酸 | 石灰石 | 饱和 | 制备 | |
C | 稀硫酸 | 溶液X | 澄清石灰水 | 验证溶液X中是否有 | |
D | 70%硫酸 |
| 酸性 | 证明 |
A. A B. B C. C D. D
【题目】工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)△H
CH3OH(g)△H
(1)该反应的平衡常数表达式为_______;
(2)如表所列数据是反应在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H______0(填“>”、“=”或“<”);
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10s后达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为____,用H2表示反应速率为_____,此时的温度为______;
(3)要提高CO的转化率,可以采取的措施是______;
a.升温 b.加入催化剂 c.增加CO的浓度
d.恒容充入H2 e.恒压充入惰性气体 f.分离出甲醇